Күшті протолиттер ерітіндісіндегі рһ. Су бойындағы протолиттер (қышқыл-негіздер)
Оңтүстік Қазақстан обылысы
Шардара ауданы
№ 16 колледж студенті
Орындаған: А-41 топ студенті Ұшқын Нұрбек Қайратбекұлы
Еріткіш бойында еріген протолит күшті қышқылдар қатарына жататын болса, онда төмендегі тепе-тендік оң бағытқа ығысқан, яғни рКА < 0:
A + HSolv ⇔H2Solv+ + B
Hcl + H2O ⇔ H3O+ + Cl-
Мұндағы рКНСІ мәні теріс болған сайын, еріген қышқыл лионий иондарына толығымен өтеді.
Күшті протолиттер үшін автопротолиз нәтижесінде түзілетін лионий ионының концентрациясын протолит концентрациясы 10-6 моль/л-ден төмен болғанда ғана ескеруге болады.
Өзге жағдайларда, лионий ионының концентрациясы сол протолиттың аналитикалық концентрациясына тең деп қабылданады, яғни:
[H2Solv+] =CA
Айтқанымыз түсінікті болу үшін мысал қарастыралық.
1 - мысал. 0,1 молярлы тұз қышқылының судағы сутектік көрсеткішін анықтау керек болсын. Берілген ерітіндінің концентрациясы 0,1 моль/л. Демек,
[H2Solv+] =[H3O+]=C(HCl), яғни [H3O+]=0.1моль/л
ph= - lg[H2Solv+] = - lg[H3O+]= - lg10-1=1
Дәл осындай есептеулер күшті негіз (рКв < 0) ерітілген жағдайда да орынды, яғни лиат иондарының концентрациясы негіздің аналитикалық концентрациясына тең деп алынады:
B+HSolv ⇔ A+Solv-; CB= [Solv-]
Әлсіз протолиттер ерітіндісіндегі рН
Әлсіз қышқыл үшін рКА > 0, яғни
A+HSolv ⇔ H2Solv+ +B
A+H2O ⇔ H3O+ +B
теңдеулерінде тепе-теңдік солға қарай ығысқан.
Мұндағы А - әлсіз қышқыл, HSolv- кез-келген еріткіш, B - сабақтас түзілген негіз.
Қышқыл өте аз мөлшерде ионға ыдырайтын болғандықтан, оның бастапқы концентрациясы тұрақты ([А] = Сд), ал түзілген лионий және лиат иондарының концентрациясы өзара тең деп есептелінеді, яғни:
[B] = [H2Solv+] кез-келген еріткіш үшін
[B] = [H3O+] судағы еріткіш үшін.
Әлсіз қышқыл үшін оның қышқылдық константа өрнегі төмеңдегідей болып жазылады:
KA= [H2Solv+] [B] / [A]
Егер [B] = [H2Solv+] және [A] қышқыл концентрациясы C(A) екендігін ескерсек, өрнекті мына түрде жазуға болады:
KA= [H2Solv+] [H2Solv+] [/ C(A)= [H2Solv+]2/C(A)
Бұл тендіктен лионий ионының концентрациясы былайша анықталады:
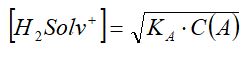
Ал, pH= - lg[H2Solv+] екендігін ескерсек, әлсіз қышқыл үшін сутектік көрсеткіш - қышқылды константа және сол қышқылдың концентрациясына тәуелді болады, яғни:
pH= -1/2 lg KA -1/2 lg C(A)
Тақырып түсінікті болу үшін мысалдар қарастыралық.
1 - мысал. 0,1 молярлы сірке қышқылының судағы сутектік көрсеткішін есепте.
Шешімі. Әлсіз протолит үшін рН - шамасын жазып қоямыз:
pH= -1/2 lg KA -1/2 lg C(A)
Есеп шарты бойынша C(A)= 0,1 моль/л.
КА шамасын анықтама құралында келтірілген кестеден аламыз. КСНзСООН = 1,74·10-5. Осы орайда бірден рКСНзСООН - мәнін пайдалана берсе де болады, өйткені рКА = -lgКА; pКСНзСООН = 4,8.
Табылған мәндерді теңдеудегі орындарына қойып рН -шамасын есептейміз:
pH=1/2 *4.8- 1/2 lg 0.1=2.9; Орта қышқылдық.
Су бойындағы протолиттер (қышқыл - негіздер)
Өткен тақырыптарды қысқаша еске түсіріп өтелік. Таза судың өзі де аз да болса ионға ыдырайды. Түзілген сутек және гидроксил иондарының концентрациясының көбейтіндісін судың иондық көбейтіндісі деп аталады, яғни:
KW=[H+][OH-]
Келтірілген шамалардың теріс ондық логарифмдерін lgKw, -lg [H+] және -lg[OH-] -ды, pKw, рН және рОН деп белгілеп судың иондық константа көрсеткіші, сутектік көрсеткіш және негіздік көрсеткіші деп атадық. Жалпы жағдай үшін, pKHSolv, pH және pSolv екендігі есімізде болар.
Судағы ерітінділер үшін, оның қышқылдығы немесе негіздігін сипаттайтын сутектік көрсеткіші шамасы нольден он төртке дейінгі мәндерге ие бола алады, яғни:
0<pH<pKw немесе 0<pH<14,
жалпы еріткіштер үшін:
0<pH<pKHsolv
Ерітінді қышқылдық та, сілтілік те қасиет көрсетпесе судағы орта бейтарап болып, сутектік көрсеткіш мәні жетіге теңеледі.яғни:
рН = рОН = 7.
Қышқылдық орта үшін: рН< 7.
Негіздік орта үшін: рН > 7.
Еңді осы судағы ерітінділер үшін рН мәнін есептеулермен танысалық.
I. Суда ерігеңде Н+ немесе ОН- иондарын түзетін, толық ионға ыдыраған заттар үшін, аталған иондар концентрациясы сол заттың алынған аналитикалық концентрациясына тең деп есептелінеді. Мысалы, 0,01 молярлы тұз қышқылының сутектік көрсеткішін есептелік.
Өзіміздің жоғарыдағы шарт бойынша
[Н+] =С(НС1).
Демек, [Н+] = 0,01 моль/л. Олай болса рН - мәні мынаған тең:
рН = -1g [Н+] = -1g 0,01 = -1g 10-2 = 2.
Ал, егер 0,01 молярлы күкірт қышқылы берілсе, оның рН мәнін анықтау үшін диссоциациялану теңдігін жазып аламыз:
H2SO4 ⇔2H+ + SO-24
Сутeк иондарының концентрациясы қышқыл концентрациясына қарағанда екі есе жоғары, яғни:
[Н+] = 2·С(Н2S04) = 2·0,01 = 0,02 моль/л.
рН шамасын есептейміз
рН = -1g [Н+] = -1g 0,02 = -1g 2·10-2 = 2 -1g 2 = 1,7.
Cуда сілті ерітіндісі болған жағдайда өзімізге таныс pH+рОН = 14 теңдігі пайдаланылады.
Мысалы, 0,1 молярлы натрий гидрооксидінің сутектік көрсеткішін есептеу қажет болсын. Ол үшін натрий гидрооксидінің судағы диссоциациялануын жазып аламыз
NaOH⇔Na+ +OH-
Теңдіктен С(NaOH) = [OH-] = 0,1 моль/л.
Ерітінді рН шамасын есептейміз:
рН=14-рОН
рН = 14 - (-lg 0,1) = 14 - (-lg 10-1) =14-1 = 13.
рН > 7. Орта сілітілік.
Құрамында гидроксил топшасы бірден жоғары, мысалы, 0,01 молярлы Ва(ОН)2, ерітіндісін қарастыралық. Диссоциациялану теңдеуін жазып [ОН-] - шамасын анықталық.
Ва(ОН)2↔Ва2+ + 20Н-
[ОН-] =2 С(Ва(ОН)2) = 2·0,01 = 0,02 моль/л
рОН = -lg [ОН-] = - lg 0,02 = - lg 2·10-2 =2 - lg 2 =1,7
рН= 14-рОН=14-1,7 = 12,3.
Суда ерігенде Н+, ОН- иондарына толық ыдырамайтын қышқыл - негіздер үшін сутектік көрсеткішті есептеуде диссоциациялану дәрежесі (α) және диссоциациялану константасы К - пайдаланылады.
Диссоциациялану константасының мәні протолиттік ілімдегі қышқылдық константа КА және негіздік константа Кв шамаларымен сәйкес келеді.
Егер α - мәні белгілі болса, онда сутек иондарының концентрациясы былайша анықталады:
[Н+] = α С
рН = - lg α С.
Енді, тепе-теңдік константа мәнін пайдаланып рН -ты есептелік. Кез-келген НАn - қышқыл үшін, оның диссоциациялану константасының өрнегі төмендегіше жазылады:
НАn⇒H++An-;
KA=[Н+] [An-] /[HAn]
Қышқыл концентрациясын оның ионға ыдыраған және ыдырамаған бөліктерінің қосындысы ретінде қарастырсақ, мына теңдік орынды:
С = [НАn] + [Аn-].
Ерітіндінің электробейтарап қасиетінен [Аn-] = [Н+] екендігі шығады, яғни тепе-теңдік константа өрнегінде осы жағдайды ескерсек төмендегідей өрнек аламыз:
KA=[Н+] [Н+] /C-[Н+] =[Н+] 2/C-[Н+]
Осы теңдікті шешіп [Н+] -ты анықталық
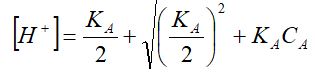
Көп жағдайда C>> [Н+] болғандықтан, жуықтап есептеулерде төмендегіше жүргізе береді:
KA=[Н+] 2/C-[Н+]=[Н+] 2/C
Ал бұл тендіктен сутектік көрсеткіш мәні төмендегіше анықталады:
pH=1/2pKA - 1/2 lgC
Мұндагы рКА - қышқылдық константа көрсеткіші.
Жалпы, бұл теңдікті пайдалану үшін дәлдіктің ауытқу шамасын 5% деп алсақ, онда мына шартты теңсіздік орындалуы тиіс:
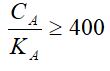
1 - мысал. Молярлығы 0,035 моль/л сірке қышқылының қышқылдық константа шамасы КА=1,75·10-5. Осы қышқыл ерітіндісінің рН -мәнін анықта.
Шешімі. Бірінші кезекте теңсіздік шартының орындалуын тексерелік
СА/KA=0.035/1.7*10-5=2000, яғни 2000 > 400.
Олай болса, жуыктап есептеулер формуласын пайдаланып рН-ты есептейміз.
pH=1/2pКА-1/2lgСА pKCH3COOH=4.7
pH=1/2*4.77-1/2lg0.035=4.77/2-1/2lg3.5*10-2 ≈ 2.39+1.46/2=3.12
Әлеуметтік желілерде бөлісіңіз:
Пікірлер (0)
Пікір қалдырыңыз
Қарап көріңіз
Басқа да жазбалар
- Жаңылтпаш
- Интернет немесе газет: цифрлық дәуірдегі ақпарат үшін шайқас
- Мәдениет - Қазақ елінің рухани құндылықтарының қазынасы
- Қазақ ұлттық университетінің жетістіктері
- Өнер-білім бар жұртта…
- Сайып қыран саралаған "Жаңа кітап" Мұхамеджан Сералин
- Қазақстанға жер аударылған халықтар тарихы
- Тілдік өзгерістер: Қазақ тілі мемлекеттік рәміз ретінде
- Заманауи мәдени құбылыстарды зерттеудің жаңа теориялары
- Бүгінгі қазақ кинематографиясынан жаңалықтар
- Қазіргі қоғамдағы метамодернизм көрінісі
- «Масс-медиа туралы» заң жобасын білесіз бе?
- Құрылымдық талдау және оның басты принциптері
- Место жетыгена в казахской музыкальной культуре
- Дене шынықтыру



- Альфред Адлер
- Альфред Адлер
- Альфред Адлер
- Альфред Адлер
Барлық авторлар
Ілмек бойынша іздеу
Мақал-мәтелдер
Қазақша есімдердің тізімі