Ерітінді рҺ - мәнінің қышқылдар диссоциациясына әсері
Оңтүстік Қазақстан обылысы
Шардара ауданы
№ 16 колледж студенті
Орындаған: Э-45 топ студенті Жолдыбай Өтемұрат Мұратұлы
Қышқылдардың судағы ерітіндісінде олардың ионға ыдырайтындығы белгілі, яғни
HAn⇒H++An-
Ле-Шателье шарты бойынша ерітіндіде сутек иондарының артуы, тепе-теңдікті сол бағытқа қарай ығыстырады. Демек, ерітіндідегі рН көрсеткішінің кішіреюі, диссоциацияға ұшырамаған қышқылдар шамасын арттыруы тиіс. Осы шамаларды сандық тұрғыда сипаттау үшін, қышқылдардың ионға ыдыраған және ыдырамаған бөлшектерін пайдаланып есептеулер жүргізеді.
Кышқылдың ионға ыдырамағанын [НАn], ал бастапқы концентрациясын СHAn деп белгілесек, онда диссоциацияға ұшырамаған бөлігін α0-деп есептеуге болады, яғни:
α0= [НАn]/СHAn
Ал, ионға ыдыраған бөлігін түзілген аниондар мөлшерін жалпы концентрацияға бөлу арқылы анықтайды:
α1= [Аn-]/СHAn
Келтірілген екі шаманың қосындысы бірге теңелетіні мәлім, яғни:
α0+α1=1 және [НАn]+[Аn-]=СHAn
Олай болса
α0= [НАn]/ [НАn]+[Аn-]
α1= [Аn-]/ [НАn]+[Аn-]
Теңдіктің оң жағының алымын да бөлімін де мүшелігіне көбейтіп жіберсек, төмендегідей өрнектер аламыз:
α0= [Н+]/ [Н+]+KHAn
α1= KHAn/ [Н+]+KHAn
Бұл теңдіктерден шығатын тұжырым: а) егер, [Н+] >> КНАn болса, α=1, яғни қышқыл диссоциацияланбаған түрінде ұшырасады.
ә) [Н+] << КНАn, яғни α=1, қышқыл толық ионға ыдыраған.
6) α0=α1=0.5. Бұл жағдайда [Н+] = КНАn. ; рН = р КНАn.
7-дәріс Көп негізді қышқылдардың рН - мәні және қышқыл диссоциацнясына әсері
Әлсіз көп негізді қышқылдар суда сатылап диссоциацияланады. Мысалы, екі негізді қышқыл үшін ионға ыдырау екі сатыда жүреді:
H2An⇔Н++HAn- І- сатысы;
HAn- ⇔ Н++An2- ІІ -сатысы.
Әрекеттесуші массалар заңы бойынша тепе-теңдік константасын жазалық:
KI=[Н+] [НАn-]/[Н2Аn]; KII=[Н+] [Аn2-]/[НАn-];
Көп жағдайда екі сатысын біріктіріп қарайды, яғни:
K=KI=KII=[Н+]2 [Аn2-]/[Н2Аn];
Мұндағы KI - диссоциацияланудың I - сатысының константасы;
KII - диссоциацияланудың II- сатысының константасы;
K - диссоциациялану константасы.
Ерітілген қышқыл концентрациясы иондар концентрацияларының қосындысына тең
CA=[Н2Аn]+[НАn-]+[Аn2-]
Енді, теңдеудегі [Н2Аn] және [НАn-] орнына тепе-теңдік константасы арқылы өрнектелген мәндермен алмастыралық. Ол үшін жоғарыдағы теңдіктерден [Н2Аn] және [НАn-]-ды анықтаймыз.
KI*KII=[Н+]2 [Аn2-]/[Н2Аn] [Н2Аn]=[Н+]2 [Аn2-]/KI*KII
KII=[Н+]2 [Аn2-]/[НАn-] [НАn-]=[Н+]2 [Аn2-]/KII
Теңдіктің оң бөлігін ортақ бөлімге келтіріп, жақша сыртына [Аn2-] шығарып жазсақ, төмендегідей өрнек аламыз:
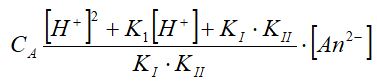
Ерітіндідегі қышқылдың ионға ыдырамаған бөлігінің үлесі α0, [НАn-] - үлесі - α және [Аn2-] - үлесі - α2 мына қатынастан анықталады:
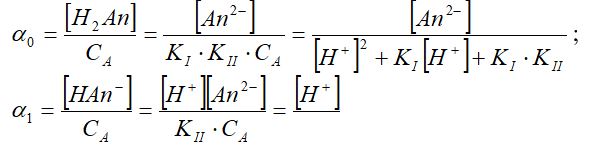
Негіздігі "n" - ге тең қышқыл үшін осындай теңдіктердің ортақ бөлімінің (n +1) - ге тең мүшелігі болады. Мысалы, үш негізді Н3Аn қышқылы үшін ортақ бөліміндегі мүшелік саны төртке теңеледі, яғни:
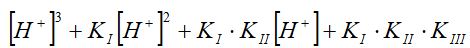 .
.
Ал әрбірінің үлесін есептеуде олардың өздері алымы болып табылады. Мысалы, жоғарыдағы үш негізді қышқыл үшін [Н3Ап], [Н2Аn-] [НАn2-] және [Аn3-] үлестері төмендегіше анықталады:
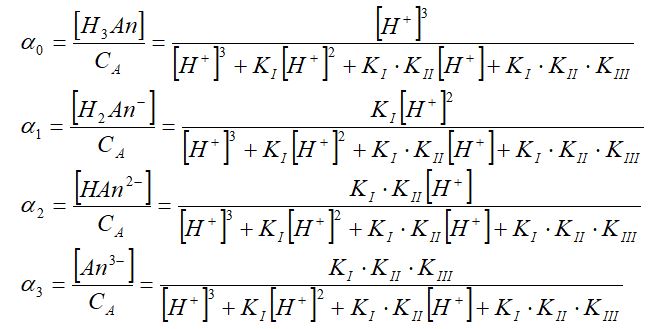
Бір қарағанда күрделі болып көрінетін теңдіктің бөлімі бірдей, ал алымы жоғарыдағы мүшеліктер болып табылады. Айтқанымыз түсінікті болу үшін мысал қарастыралық.
1 - мысал. 0,1 молярлы көмір қышқылы үшін оның судағы ерітіндісіндегі рН -мәнін жуықтап есепте.
Шешімі. Көмір қышқылы үшін
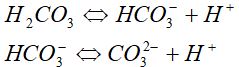
Тепе-теңдік немесе диссоциациялану константа шамалары:
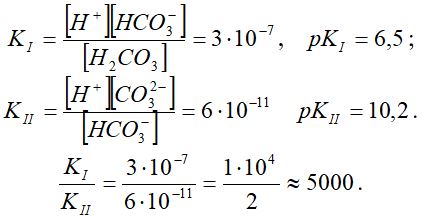
Демек, қышқылдың екінші сатысындағы диссоциациялану біріншіге қарағанда 5000 еседей аз. Олай болса, сутектік көрсеткіш мәнін қышқылдың диссоциациялануының бірінші сатысы бойынша жүргізе беруге болады, яғни: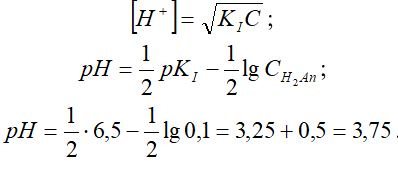
Әлеуметтік желілерде бөлісіңіз:
Пікірлер (0)
Пікір қалдырыңыз
Қарап көріңіз
Басқа да жазбалар
- Жаңылтпаш
- Интернет немесе газет: цифрлық дәуірдегі ақпарат үшін шайқас
- Мәдениет - Қазақ елінің рухани құндылықтарының қазынасы
- Қазақ ұлттық университетінің жетістіктері
- Өнер-білім бар жұртта…
- Сайып қыран саралаған "Жаңа кітап" Мұхамеджан Сералин
- Қазақстанға жер аударылған халықтар тарихы
- Тілдік өзгерістер: Қазақ тілі мемлекеттік рәміз ретінде
- Заманауи мәдени құбылыстарды зерттеудің жаңа теориялары
- Бүгінгі қазақ кинематографиясынан жаңалықтар
- Қазіргі қоғамдағы метамодернизм көрінісі
- «Масс-медиа туралы» заң жобасын білесіз бе?
- Құрылымдық талдау және оның басты принциптері
- Место жетыгена в казахской музыкальной культуре
- Дене шынықтыру



- Альфред Адлер
- Альфред Адлер
- Альфред Адлер
- Альфред Адлер
Барлық авторлар
Ілмек бойынша іздеу
Мақал-мәтелдер
Қазақша есімдердің тізімі