Электродинамика бөлімі бойынша демонстрациялық құрылғыларды құрастыру үлгісі
С.Аманжолов атындағы Шығыс Қазақстан Мемлекеттік Университетінің
4-курс студенті Әкбар Нұржау Жолдасбайұлы
Жұмысты жүргізудегі негізгі мақсатым электролит диссоциациясы дәрежесінің концентрацияға тәуелділігін анықтауда экспериментті қолданып, алынған нәтижені теориялық мәліметтермен салыстыру.
Жалпы таза сұйықтар электр тогын нашар өткізеді. Тұз, қышқылдардың және тағы басқа заттардың сумен ерітіндісі токты жақсы өткізеді.
Бұл құбылысты ерігіш заттың молекуласы диссоциацияланады, яғни оң және теріс иондарға ыдырайды. Егер ерітіндіде молекулалар диссоциацияланбаса, онда ерітінді электр тогын өткізбейтіндер қатарына жатады.
Оң және теріс иондар қозғалысы әртүрлі болады.
Иондар концентрациясы диссоциация дәрежесіне тәуелді, α диссоциация коэффициентімен белгіленіп, N ион концентрациясы мен N0 зат ерітіндісінің концентрациясының байланысымен былай өрнектеледі:
N=αN0
Бұдан кейін молекуланың диссоциацияланбаған концентрациясы
N^/=(1-α)N0
Ерітінді де бір уақытта және үздіксіз молекула диссоциациясы сияқты иондардың мольденуі, сонымен бірге бейтарап молекулаларының иондарының бірігуі жүреді. Бұл екі үрдістің теңелудегі интенсивтілігі кезінде қарама-қарсы бағытта ерітінді құрамының өзгерісі тең. Әрбір ион концентрациясының жылдамдығының өзгерісі (dN/dt) молекулалардың диссоциациялануы кезіндегі нәтижесінде N/ диссоциацияланбаған молекула концентрациясына пропорционал:
(dN/dt)=β(1-α)N0, (1.38)
мұнда, β- пропорционалдық коэффициент.
Диссоциацияланбаған молекулалардың жылдамдығының өзгерісі (dN/dt) иондардың иондалуының нәтижесінде оң және теріс иондардың концентрациясының туындысына пропорционал:
(Nl/dt)=ηα2 N02,
мұнда, η- пропорционалдық коэффициент. Теңістіру кезінде
(dN/dt)=(Nl/dt). (1.39)
(1.38) мен (1.39) формулаларынан ерітінді заттың концентрациясымен байланыстыратын диссоциация коэффициент төмендегідей өрнектеледі:
(1-α)/α2 =η/β N0 (1.40)
Диссоциация коэффициенті зат ерітіндісінің концентрациясына тәуелді екенін байқаймыз. Әлсіз концентрация кезінде N0=0 болғанда α=1, толық диссоциациялануға жақын екенін білеміз. Егер α<<1, онда (1.40) формуладан
α=√(β/γ) 1/√(N0) (1.41)
Сондықтан α ерітінді заттың концентрациясы ұлғайған сайын азаяды.
Ерітіндінің аз көлемдегі концентрация кезінде диссоциация коэффициенті тұрақты шама болып табылады, иондардың қозғалу соммасы шамамен тұрақты болып табылады. Бұдан шығатыны ерітіндінің аз концентрациясы кезінде электрөткізгіштік концентрацияға пропорционалды, ал жоғары кезінде тәуелділік қиындайды. Осыдан жұмыстың мақсаты туындады.
Токтың электродтар арқылы өтуі иондардың қозғаласымен сипатталатындықтан, нітижесінде еріген заттың құраушы бөліктерге бөлінуі жүреді, ол электродтарда байқалады. Бұл үрдіс электрлиз деп аталады. Электр тоғын өткізушілер, ішінен тоқ өткен кезде диссоциациаланады, яғни құраушы бөліктерге бөлшектенетіндіктен электролит деп аталады. Айтылғандарда түсінетініміз, электролит болып көпшілік тұздардың, қышқылдардың және сілтілердің ерітінділері, сондай-ақ сұйық және қатты күйдегі бірқатар химиялық қосындылар қатары жатады [13].
Эксперимент нәтижесі.
Экспериментті жасауда электролит негізінде мыс купоросы алынды. Электр тізбегі төменде көрсетілген:
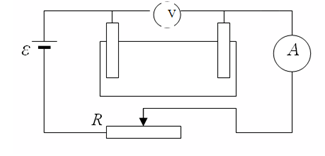
мұнда, R тізбектегі кедергіні реттейтін реостат.
Амперметр көмегімен ток күшін, ал вольтметр көмегімен кернеуді анықтаймыз.
Электролитті астаушаны CuSO4 ерітіндісімен толтырып, мыс өткігіштер – анод пен катод орнатамыз. Мыс купоросының салмағын арнайы техникалық гірмен өлшеп алдық. Сызбаны жинай отырып, ток мынаған тең екенін ескереміз I=jS , мұнда S - ерітіндіге орналастырылған электродардың арақашықтығы. Ток өткіземіз. Тәжірибе бойы реостат көмегімен тұрақты токты реттеп отырдық [2].
Тәжірибе төрт рет жасалынды. Алынған нәтижелерге төмендегі формулалармен есептеулер жүргізілді:
R=U/I=1/σ L/S,
мұнда, σ-иондар концентрациясына тәуелді меншікті өткізгіштік.
σ=LI/SU
Меншікті өткізгіштік пен диссоциация дәрежесінің байланысын анықтайық. Бізге белгілі ток тығыздығы төмендегідей анықталады:
J=neα(b+ - b- )E (1.42)
Мұндағы, n-молекула саны, е-электрон заряды, σ- диссоциация коэффициенті, b+ және b— иондар қозғалысы.
Егер J=σE, онда (1.42) формуладан
σ=neα(b+ - b- )E (1.43)
Бірлік көлемдегі зат ерітіндісінің молекула саны мына формуламен анықталған:
n=m/μ NA/V
мұнда, m- мыс купоросының массасы, µ-ерітінді заттың мольдік массасы , NA- Авагадро саны, V-сұйық көлемі.
Сонымен, (1.43) формуладан мыс купоросының диссоциация дәрежесін анықтаймыз:
α=σ/nq(b++b-) (1.44)
Тәжірибе нәтижесі. Әлсіз электролиттер теориясымен салыстыру.
Әлсіз электролит диссоциацияланған ерітінділерде иондарға жартылай ыдырайтынын білеміз. Теориялық мағлұматтар мен алынған тәжірибелік нәтижелерді салыстыра отырып, кестеге мәндерін енгіздік.
2- кесте Электролит диссоциациясы дәрежесінің концентрацияға тәуелділігін анықтау
|
№ |
n % |
t0 C |
h (см) |
l (см) |
σ |
α |
|
1. |
2 |
25 |
2.3 |
8 |
4.5 |
4*10-4 |
|
2. |
4 |
25 |
2.3 |
8 |
5.6 |
5*10-4 |
|
3. |
6 |
25 |
2.3 |
8 |
2.4 |
2.1*10-4 |
|
4. |
8 |
25 |
2 |
7 |
2.4 |
2.1*10-4 |
Тәжірибеде алынған көрсеткіштер мен есептеулер төмендегідей жүргізілді:
Ом заңының көмегімен меншікті өткізгіштік формуласын теңестіре отырып, меншікті өткізгіштің мәнін тауап аламыз:
R= U/I=1/σ∙l/h
бұдан
σ=lI/hU
Сонымен, (1.44) формуладан мыс купоросының диссоциация дәрежесін анықтаймыз:
α=σ/(nq(b++b-)
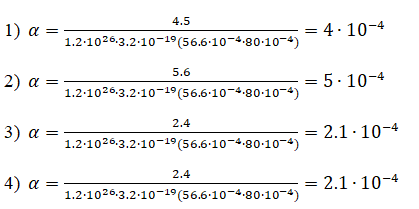
Тәжірибенің бірнеше рет қайталанып жасалуына байланысты 3 рет өлшемдерді салыстыра отырып, ортақ нәтижесін алып тұрғызылған сызба төменде берілген.
Судағы мыс купоросының әр түрлі салмақтағы ерітіндісінің электролитті диссоциация дәрежесіның нәтижесі сызба түрінде бейнесі:
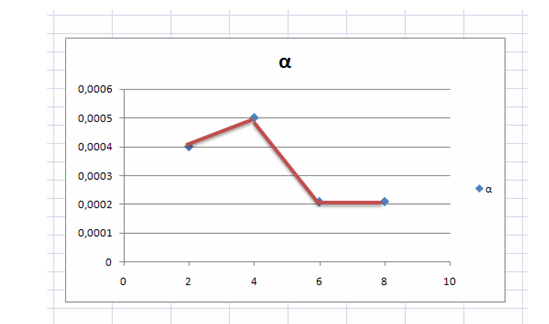
Сурет 1 Мыс купоросы судағы ерітіндісінің электролитті диссоциация дәрежесінің концентрацияға тәуелділігі
Жүргізілген тәжірибенің қорытындысы бойынша мыс купросының судағы ерітіндісінен әлсіз электролит пайда болды. Заттардың көпшілігі ерітінді күйінде реакцияға түсетінін ескереміз. Мыс купоросының иондарға ыдырау су молекуласының қатысуымен жүзеге асады.
Сызбада көрсетілгендей 6% ерітінді концентрациясында электролит дәрежесінің жоғары көтеріліп, қайта төмендегенін көрдік. Бұдан шығатын қорытынды теориялық мағлұматтарда көрсетілгендей тәжірибе нәтижесіде соған сәйкес келді.
СПИСОК ЛИТЕРАТУРЫ
1. Матвеев А.Н. Электричество и магнетизм: Учебное пособие. 3-е изд., стер.-СПб.: Издательство «Лань», 2010.-464 с.: ил.-(Учебники для вузов. Специальная литература).
2. Сакенова Р.Е. О теории теплоемкости жидкостей / Р.Е. Сакенова, А.М. Павлов // Сборник материалов Российско-Казахстанской молодежной научно-технической конференции / Алтайский государственный университет. -Барнаул, 2013. –Б.57-60.
Әлеуметтік желілерде бөлісіңіз:
Пікірлер (1)
Пікір қалдырыңыз
Қарап көріңіз
Басқа да жазбалар
- Мәдениет - Қазақ елінің рухани құндылықтарының қазынасы
- Тарихи тұлға - Ораз Жандосов
- «Жергілікті және оралған қазақтардың бірегейлік қақтығысы: қазақстандық көші-қон саясаты және репатрианттардың мәдени интеграциялануы мәселесі» жобасы
- Әл-Фараби мен түркі ғұламаларының мұрасындағы ізгі адам: компаративистік дискурс
- Өнер-білім бар жұртта…
- Сайып қыран саралаған "Жаңа кітап" Мұхамеджан Сералин
- Еліміздің жүз жыл бұрыңғы көрінісі
- Қазақстандағы ең төменгі табыстың көрсеткіші мен әлеуметтік аспектілері
- Желтоқсан — Тәуелсіздіктің бастауы
- Қазақстанға жер аударылған халықтар тарихы
- Қазақтың ұлттық бас киімдерінің семиотикасы
- Аккультурация мәдениетаралық коммуникацияның бір түрі ретінде
- Лидерлік дағдыларды түсіну және қолдау
- Бастауыш сыныптың “Көркем еңбек” сабақтарында оқушылардың шығармашылық іс-әрекетін дамыту мүмкіндіктері
- «Масс-медиа туралы» заң жобасын талдау



- Альфред Адлер
- Альфред Адлер
- Альфред Адлер
- Альфред Адлер
Барлық авторлар
Ілмек бойынша іздеу
Мақал-мәтелдер
Қазақша есімдердің тізімі