Сирек элементтер. Ванадий
Оңтүстік Қазақстан обылысы
Шардара ауданы
№ 16 колледж
Орындаған: Э-45 топ студенті Әмірқұл Нұрғали Дуйсенбайұлы
Жетекшісі: Айтенова Нұргул Ыдырысқызы
Жоспар:
1. Жалпы мағлұматтар
2. Химиялық және физикалық қасиеттері
1. Бірінші рет жаңа элемент ванадий туралы 1802 жылы Мексика химигі Андрес дель Рио хабарлады. Дель Рио элементті қорғасынның кендерінде ашты, жаңа элементті панхромиум немесе эритроний деп атады, әр түрлі боялған (әсіресе қызыл түсті) қосылыстарды беретіндігі үшін ("эритрос" грек тілінде - қызыл). Бірақ дель Рионың хабарлауы көзге түспеді, өзінде де бұл жаңа элемент деген сенім болмады, бұл қызыл зат - қорғасын хроматы деп ойлады. 1830 жылы скандинав ғалымы Зефштрем жаңа элементті норвег темір кендерінде ашып, оны Скандинавия мифологиясына байланысты - көркемдік, сұлулық әйел құдай Ванадистың құрметіне "ванадий" деп атады. Бірінші болып ванадийді металл түрінде алып және оның ең маңызды қасиеттерін зерттеген ғалым Роско (оның атымен ванадий минералы "роско" деп аталған).
1834 жылы ванадий Оралда (Ресей) табылды.
2. Ванадий периодтық жүйенің бесінші тобына кіреді. Оның аналогтары ниобий мен тантал. Ванадийдің реттік нөмірі 23, атомдық массасы 50,95. Жоғары валенттілігі бес, басқа валенттілікте ванадий өзгеше, себебі валенттілік өзгергенде ерітінділердің түсі де өзгереді:
Ванадий валенттілігі Ерітіндінің түсі
5 Әлсіз сары
4 Көк
3 Жасыл
2 Күлгін
Ең тұрақты бес валентті ванадийдің қосылыстары, бұл ванадийдің атомындағы электрондардың орналасуына байланысты: 2,8,11,2. Атомның радиусы 1,36 А°. Тығыздығы 5,5-6,025 г/см3, балқу температурасы 1680°-1760°С (әр түрлі анықтамаларда).
Ванадий металл түрінде ауада тұрақты созылмалы, жақсы өңделеді, жылтырайды. Қаттылығы болаттан жоғары. Ванадийдің реакцияшылдық қасиеттері жоғары болғандықтан, металл түрінде бөлінуі қиын. Ванадийді қыздырғанда – көміртекпен, сутекпен, азотпен, хлормен, броммен және күкіртпен әрекеттеседі. Оттекте ванадий жанып ванадий оксидін түзеді:
2V+21/2O2 →V2O5 + 437ккал/моль
Ванадий сұйытылған қышқылдарға тұрақты. Суықта "патша сұйығында" және азот қышқылында ериді. Қыздырғанда концентрлі күкірт және фтор қышқылдарда ериді. Ванадий сілті ерітінділерде тұрақты, балқыған сілтілерде жай ерiп, ванадий қышқылының тұздарын — ванадаттарды түзеді.
Ванадий легирлейтін элемент болғандықтан металлургияда ролі зор. Ванадийдің әр түрлі металдармен құймалары толық зерттелген, олардың құрылымы және коррозиялық тұрақтылығы туралы мына әдебиеттерден табуға болады.
Оттекпен қосылыстар
Ванадийдің барлық валенттілігіне (2-ден 5-ке дейін) сәйкес оксидтер белгілі. Ең маңыздысы ванадийдің (V) оксиді — V2O5 - ұнтақ түрінде қызыл-қоңыр түсті зат. Балқу температурасы 650-675°С. Ванадий оксидін ванадий металын оттекпен тотықтырғанда немесе кез келген ванадий қосылыстарын термиялық ыдыратқанда алуға болады.
Ванадий оксиді суда ерімейді, сілтілердің ерітіндісінде еріп, ванадий қышқылының тұздарын — ванадаттарды түзеді. Ванадий оксиді фосфордың оксидіне ұқсас болғандықтан қышқылдың бірнеше түрін береді: метаванадий HVO3, диванадий H4V2O7, ортованадий H3VO4 - қышқылдары.
Ванадий қышқылы (көбіне метаванадий қышқылы деп аталады) - әлсіз қышқыл (диссоциациялану константасы 110-4) болғандықтан қышқыл да негіз сияқты болып мына схема бойынша диссоциацияланады:
HVO3⇔H+ + VO-3
HVO3⇔VO+2 + OH-
Қышқыл ерітінділерде диссоциация екінші схема бойынша жүреді. VO2+ - ванадан-ион деп аталады, бұл катион тотықтырғыш қасиеттерін көрсетеді: күшті қышқыл ерітінділерде тұз қышқылын хлорға дейін тотықтырады:
2VO2+ + 4H+ + 2Cl →2VO+2 + Cl↑+2H2O
Реакция арқылы төрт валентті ванадий түзіліп, ерітінді көк түске боялады. VO 2+ - ванадил-ион деп аталады.
Ванадийдің бес валентті қосылыстары бар улы заттарға жатады.
Ванадийдің төменгі оксидтері
Ванадийдің диоксиді - VO2 - қара-көк немесе алу әдісіне байланысты қара-жасыл ұнтақ.
Ванадий диоксидін ванадий оксидінен тотықсыздандыру арқылы алуға болады, мысалы қымыздық қышқылымен балқу арқылы. Ванадий диоксиді - амфотерлі қасиеттер көрсетеді: қышқылдардың ерітіндісінде еріп ванадил-ионды VО2+ береді, ал сілтілердің ерітіндісінде ванадиттерді түзеді - гипованадий H2V4O9 (немесе Н2О ∙ 4VO2) қышқылының тұздары. Гипованадий қышқылы изополиқышқылдар сияқты қарастыруға болады, ал оның тұздары - комплексті қосылыстар ретінде Me2(V4O9)- 7Н2О. Ванадил катионы әр түрлі қышқылдармен тұздар түзеді, мысалы күкірт қышқылымен VOSO4 — ванадил сульфаты:
VO 2+ + H2SO4→VOSO4+2H+
Ванадий (III) оксидін V2O5 ванадий (V) оксидінен 700°С температурада сутекпен тотықсыздандыру арқылы алуға болады. V2O3 - қара кристалды ұнтақ, қышқылдарда жай еріп, үш валентті катион береді V3+. Үш валентті ванадийдің тұздары сілтілермен әрекеттесіп көк түсті ванадий гидроксидін V(OH)3 түзеді, ауада гидроксид тотығады. Үш валентті ванадийдің қосылыстары күшті тотықсыздандырғыштар.
Екі валентті ванадийдің оксиді VO ванадий (V) оксидінен 1700°С температурада тотықсыздандыру арқылы алынады. VO - қара ұнтақ, қышқылдарда ерігенде екі валентті катионды береді V2+. VO - күшті тотықсыздандырғыш болғандықтан сутекті судан бөліп шығарады. Бес валентті ванадийдің оксиді V2O5 балқыма түрінде сілті металдардың тұздарымен әрекеттесіп, суығанда ванадий бронзалары деген қосылыстар түзеді (вольфрам бронзалары сияқты) жалпы құрамы mR2OnV2O5 (R-сілті металл). Ванадий оксиді калийдің мета- және ортофосфаттарымен әрекеттеседі.
Ванадий қышқылының тұздары - ванадаттар
Ванадий қышқылының өте көп тұздары белгілі. Ең тұрақтысы метаванадаттар, формуласы MeVO3. Сілтілі металдардың және магнийдің метаванадаттары суда жақсы ериді.
Бұл тұздар — ақ немесе жасыл түсті кристалды заттар. Басқа металдардың метаванадаттары суда аз ериді, сондықтан ванадийді ерітіндіден бөлу үшін кальций ванадаты Ca(VO3)2 немесе темір ванадаты Ғе(VО3)3 түрінде тұнбаға түсіреді. Басқа ванадаттардың арасында ең маңызы зор аммоний метаванадаты NH4VO3.
Ерітіндіде ванадаттар ортаға байланысты ерітіндіде ванадий мен оттектің әр түрлі қатынасы бар иондары түрінде болады.
Күшті қышқылды ерітінділерде ванадий (V) үш зарядты катион VO3+ түрінде өмір сүреді, оның құрамында ванадийдің оттекке қатынасы 1:1. Қышқылдық азайғанда бұл қатынас та азаяды, рН 1-ге тең болғанда ерітіндіде бір зарядты катион VO2+ түзіледі, рН 1 мен 2 қатарда — V6O174-. Қышқылдық азайғанда иондардың құрамы келесі схема арқылы өзгереді: рН 4,3-4,7 аралығында V6O174- иондар, V3O93- немесе VO3- иондарға алмасады (метаванадий қышқылының анионы), рН 6,0-6,5 аралығында VO3- иондар VO3- иондарға алмасады (ортованадий қышқылының анионы).
Шиллер мен Тило ерітіндінің рН-ы мен ванадий иондарының арасында байланыс бар екенін көрсеткен (1 кесте).
1 кесте
Ванадий иондарының ерітіндідегі рн-тан тәуелділігі
|
pH |
Ионның құрамы |
Ерітіндінің түсі |
|
1 |
VO2+ |
Бозғылт сары |
|
2 |
V2O5*aq |
-//- |
|
4 |
Декаванадаттар |
Қызғылт сары |
|
7 |
Метаванадаттар - VO3- , (V3O9)3- немесе (V4O12)4- |
Бозғылт сары |
|
11 |
Пированадаттар (V2O7)4- немесе (HVO4)2- |
-//- |
|
14 |
Ортованадаттар VO43- |
Түссіздеу |
рН бір шамасында VO2 "ванадан" деген катион түзіледі. Өте қышқыл ортада (12-14 н H2SO4) ерітінді ашық қызғылт түске боялады, бұл тек VO3+ катионының түзілуіне байланысты.
Эванстың диограммасынан ванадий ионының құрамының рН-қа байланысы жақсы көрінеді (сурет).
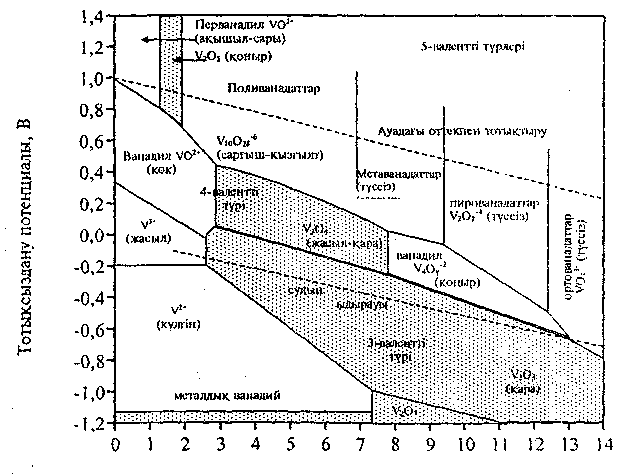
Сурет - Ванадий иондарының ерітіндідегі рН-тан тәуелділігі
(Эванс бойынша)
Көп түрлі қосылыстарды төрт валентті ванадийдің катионы — ванадил VO2+ береді. Мысалы, белгілі көк түсті ванадил сульфаты VOSO4-3H2O, суда жақсы ериді (112г/100г суда), 520-530°С температурада қыздырғанда ыдырап, ванадий оксиді V2O5 түзіледі. Сонымен қатар екі қос тұздар белгілі, мысалы, ақшыл-көк түсті K2SO4-2VOSO4, бұл қосылысты комплекс деп қарастыруға болады Me2[V2O2(SO4)3]. Ванадий (IV) рН 1,4-тен 4,5-ке дейін оксалатпен комплекс береді, құрамы [VO(C2O4)2]2-, константасы 5-10-13, шарап қышқылымен түзілетін комплекс тұрақсыз. Бес валентті ванадий роданидтің қатысында алдымен төрт валентті ванадийгe дейін тотықсызданып, сосын роданидпен көк түсті комплекс түзеді Me2[VO(CNS)4]:
VOSO4 + 4NH4CNS → (NH4)2[VO(CNS)4] + (NH4)2SO4
Төрт валентті ванадийдің реакциялары В.И.Кузнецовтың және Л.С.Козырева жұмыстарында толық келтірілген.
Төрт валентті ванадийдің сонымен қатар бір қасиеті туралы айтып кету керек: аммоний ванадаты ерітіндісі ауада тұрғанда жарық сәуленің әсерімен жарым-жартылай төрт валенттік күйге дейін тотықсызданып, аз еритін ванадил-ванадат (VO)3(VO3)2 түзіп, қоңыр-жасыл түсті түрінде тұнбаға түседі:
NaVO3 →nv VO2+ + Na+
VO2+ + NaVO3 → (VO)3(VO3)2 ↓ + Na+
Пероксидті қосылыстары
Метаванадат ерітіндісіне қышқылдатпаған сутек пероксидін қосқанда ванадийдің сары түсті пероксид қосылыстары түзіледі, олар асқын қышқылдың H4V2O10 тұздары. Бұл қышқыл таза түрінде бөлінбеген. Құрамы (NH4)2- H4V2O10 пероксид қосылысын аммоний ванадаты береді. Қышқыл ортада сутек пероксидімен қызыл-кірпіш түсті комплексті қосылыс түзіледі, құрамы [VO(H2O2)]3+. Бұл реакция өте сезгіш, сондықтан ванадийді сапалық және сандық (фотометрлік әдіс) анализінде пайдаланады. Кестеде ванадийдің пероксидті қосылыстарының құрамы келтірілген.
Галогендермен қосылыстары
Бес валентті ванадий жай галогенидтерді түзбейді, тек қана ванадий фториді VF5 белгілі, бұл фторид элементтерден 300°С температурада түзіледі.
Төрт валентті ванадий фториді VF4 және хлориді VC14 түзеді. VC14 - қызыл-қоңыр түсті сұйықтық, балқу температурасы 26°С, қайнау температурасы 152°С. Төрт хлорлы ванадий екі элемент әрекеттескенде қыздыру арқылы түзіледі. Төрт хлорлы ванадийді қыздырғанда ыдырап үш хлорлы ванадий VC13 түзіледі. VC13 - қызыл-күлгін түсті кристалды зат, судағы ерітіндісі жасыл түсті. Төртхлорлы ванадийді сутекпен тотықсыздандырғанда екі хлорлы ванадий VC12 түзіледі — жасыл түсті кристалдар, судағы ерітіндісі күлгін түсті.
Құрғақ сутек хлориді ванадий (V) оксидімен әрекеттескенде ванадийдің оксихлоридін –VOCІ3 түзеді, бұл сары түсті сұйықтық. Реакция қайтымды:
V2O5 + 6HCl ⇔ 2VOCl3 + 3H2O
2 кесте
Ванадий пероксидті қосылыстарының құрамы мен түсі
|
Ванадийдің бір атомына сәйкес оттек атомдарының саны |
Бастапқы ертінідідегі ванадий ионының типі |
|||||
|
Катион |
Декаванадат |
Метаванадат |
Пироқышқыл |
Пированадат |
ортованадат |
|
|
Жоқ |
VO2+ |
(V10O28)4- |
(V4O12)4- |
(V2O7Н)3- |
(V2O7)4 |
VO43 |
|
Ақшыл-сары |
Қызыл-сарғыш |
Ақшыл-сары немесе түссіз | ||||
|
1 |
VO3О+ |
|
|
|
|
|
|
2 |
|
|
(VO3*2О)(V2O7Н*2О)(VO4Н2О)2- сары түсті |
|
||
|
3 |
|
|
|
|
(VO4Н3О)2(VO43О)3- сары түсті |
|
| 4 |
(VO44О)4- көк түсті |
|||||
Сондықтан су қосқанда оксихлорид ыдырайды. Ванадийдің басқа оксихлоридтері белгілі — VOC12 және VOC1, бірақ олардың практикада мәні жоқ.
Күкіртпен қосылыстары
Ванадий оксидін (V) күкіртсутекпен қыздырғанда қара түсті үш валентті ванадийдің сульфиді түзіледі:
V2O5 + 5Н2S → t V2S3 + 5H2O + 2S
Ванадий (III) оксидін күкіртпен 350°С температурада қыздырғанда бес валентті ванадийдің сульфидін алуға болады:
V2O5 + 7.5S → 350C V2S5 +2.5SO2
V2S5 аммоний сульфиді және сілтілердің ерітіндісінде еріп қызыл-шие түсті сульфотүздар түзеді. Сульфотұздарды сонымен қатар ванадий оксидін сульфидтердің ерітіндісінде ерітсе немесе аммоний ванадатына аммоний сульфидін қосқанда алуға болады:
NH4VO3 + 4(NH4)2S + 3H2O → (NH4)VS4 + 6NH4OH
Сульфотұздарға қышқылдарды қосқанда ванадий сульфиді бөлінеді:
2(NH4)VS4 + 3H2SO4 → V2S5↓ + 3(NH4)2SO4 + 3H2S
Күкіртсутекті төрт валентті ванадийдің ерітінділеріне қосқанда, сульфотұздар (тиотұздар) түзіледі, қышқыл қосқанда қоңыр сульфид (V2S5) тұнбаға түседі.
Карбидтері мен боридтері
Ванадий екі түрлі карбид түзеді: кристалдық торы гексагональды — V2C және кубтық - VC. Молибден, вольфрам және танталдың сәйкес карбидтерімен V2C изоморфты, ал VC титан, цирконий, тантал және ниобийдің сәйкес карбидтеріне изоморфты.
V-B жүйесінде үш түрлі борид анықталған: VB, V3B4 және VB2; соңғының балқу температурасы — 2400°С, ал құрылымы — гексагональдық тор — титан, цирконий, ниобий және танталдың сәйкес боридтеріне изоморфты. Сонымен қатар нитридтері де белгілі V3N және VN.
Кремниймен қосылыстары
Бірінші рет ванадийдің силицидтерін V2O3 және V2O5 кремнийдің қатысында көміртекпен тотықсыздану арқылы 1902 жылы Муассан және Холл алған. Ванадий-кремнийдің диаграммасы бойынша бірнеше фазалары бар: V3Si, VSi2 жане V5Si2.
Ванадийдің кремниймен құймалары жоғары температурада тотығуға тұрақты. V3Si — жоғары өткізгіш.
Электрохимиялық қасиеттері
Анықтамалық кестелерде ванадийдің тотығу-тотықсыздану жұптарына келесі потенциалдар (В) келтірілген:
Жұптар Е0,В
VO3-/VO2+ + 1.0 (2H H2SO4)
V3+/V2+ - 0.25
VO2+/V3+ + 0.36
V2+/V - 1.2
Тотығу-тотықсыздану жұптың VO3-/VO2+ потенциалы ерітіндінің қышқылдығына байланысты. Мысалы, 27 н H2SO4-те потенциалы +1,45В. Потенциалдың осындай өзгеруі ванадий ионының ерітіндіде болу күйімен байланысты. Ванадийдің тотығу-тотықсыздану қасиеттеріне негізделіп, Н.С.Сырокомский "ванадометрия" деп аталатын анализдің титриметрлік әдісін дамытты.
Бес валентті ванадий сынап электродында оңай төрт валенттік күйге дейін тотықсызданады. Металға дейін ванадийді электролизбен, цементациямен т.б. әдістермен тотықсызданыруға болмайды, бұл реакцияға бөлінетін сутек кедергі жасайды.
А.С. Гончаренко және О.А. Суворованың жұмыстарында ванадийдің қосылыстарын «электртұндыру» әдісімен алу туралы мәліметтер келтірген.
Сынап электродын пайдаланып, бес валентті ванадийді қышқылды ерітінділерде оңай электролитикалық әдіспен, төрт валентті күйге дейін тотықсыздандыруға болады. Төменгі валенттік күйге дейін, сонымен қатар нормальды потенциалдары теріс санды металдарды пайдаланып алуға болады. Электролизбен және цементациямен ванадий металл түрінде алынбайды.
Тамшы сынап электродында әр түрлі фондарда ванадийдің полярографиялық тотықсыздану көп зерттелген. Ванадий әр түрлі төменгі валенттік күйге дейін тотықсызданады (металға дейін тотықсызданбайды).
Платина электродында бес валентті ванадий күкірт қышқылы ерітіндісінде оң потенциалда төрт валентті күйге дейін тотықсызданады, диффузия тогының жақсы толқыны күкірттің жоғары концентрациясында байқалады (16 н).
Минералдары мен кендері
Мыспен, мырышпен, қалайымен, қорғасынмен салыстырғанда ванадийдің табиғатта таралуы көбірек, бірақ ванадийдің өзі күрделі кен орнында аз кездеседі. Табиғатта ванадий әр түрлі минералдарда қоспалар ретінде кездеседі.
Ванадий титаномагниттерде кездеседі, ванадийдің мөлшері 1,5% (V2O3-кe санағанда). Ванадий шашыраңқы метасиликаттарда және сульфидтерде әр түрлі валенттілік түрде кездеседі: үш валентті күйде, VO43+ -анион, комплексті қосылыстар немесе ванадий қышқылының тұздары түрінде. Ванадий фосформен және органикалық қосылыстармен кездеседі. Мысалы, темір кендерінде, әрбір көміртектерде, асфальттарда, битумдарда, мұнайда. Ванадий кейбір теңіз жануарларының денесінде — теңіз кірпісі, асцидияда, голотурияда кездеседі. Себебі ванадийдің органикалық процестерде маңызы зор, ол ванадийдің каталитикалық әсеріне байланысты.
Ванадийдің 50-ден аса минералдары белгілі. Олардың арасында ең маңыздысы - патронит — ванадий сульфиді. Формуласы VS2 немесе V2S5. Патронит күкіртпен, кальцитпен, кремнеземмен SiO2 кездеседі. Күйдіргенде ванадий оксид V2O5 түрінде қалады, оның мөлшері 52%, басқа қо-сылыстары: темір, кремний, никель, титан, алюминий оксидтері түрінде және сульфатты күкірт қоспа түрінде қалады. Кеннің құрамы (%):
V 19.53 Fe 2.92
Sбос 4.50 Ni 1.87
Sқоспа 54,29 Si 6,88
C 3,47 Ti 0,91
H2O 1,90 Al 2,00
Патрониттің күрделі кен орны Перуде кездеседі.
Роскоэлит немесе ванадий слюдасы, құрамы KV2(AlSi3O10)(OH)2 немесе K2OAl2O2-2V2O3-6SiO2-2H2O. Ванадийдің мөлшері 22%. Күрделі кен орны Колорадода және Австралияда кездеседі.
Карнотит немесе уранның слюдасы K2U2[VO4]2O4-3H2O немесе К2О2 U2O3V2O5-2H2O, химиялық құрамы: 10,44% К2О; 63,4% UO3; 20,16% V2O5; 5,99% Н2О. Ең маңызды кен орны — Колорадо (АҚШ) және Катанга (Конго).
Тюямунит CaU2[VO4]2O4-8H2O немесе Ca(UO2)2(VO4)2nH2O. Құрамында 59,96% UO3 және 19,06% V2O5.
Ванадинит - қорғасын ванадаты Pb5(VO4)3Cl, құрамында Р2O5 AS2O5 т.б. азғана қоспалары бар.
Деклуазит (Zn, Cu)Pb(VO4)OH, құрамында 22,7% V2O5 бар.
Қазақстанда (Қаратаудың солтүстік батысында) 1959 жылы бірнеше ванадийдің минералдары табылған. Олардың арасында: ортованадаттар - гуцевичит A13[(P,V)]2 (ОН)3nН2О, альванит A13(VO4)(ОH)6-2,5H2O, русаковит Fes(VO4)2(OH)9-3H2O; поливанадаттар — ваналит NaAl8V10O38-30Н2О сатпаевит 6Al2O3V2O4-3V2O5-3H2O, бокит (Fe, Al)6V4V,2O47-18H2O.
Бірақ ванадий көбінесе басқа минералдардан және кендерден алынады, олардың құрамында ванадий қоспа түрінде кездеседі. Мысалы, темірдің кендері титаномагнетиттер, апатиттер, бокситтер, топырақтар, фосфаттар, асфальттар, асфальтиттер, битумдар, мұнай, уран кен орындары.
Технологиясы
Ванадийді кендеріне байланысты әр түрлі байыту әдістері қолданылады. Патрониттерді байыту үшін оларды күйдіреді. Мысалы, карнотит жарық түсті минерал болғандықтан оны қолмен жай жинайды. Кендерге байланысты флотация әдістерін пайдаланады.
Ванадийдің кендерін өңдегенде біріншіден ванадий оксиді V2O5 немесе ванадаттар алынады, сосын оларды өңдеп феррованадий немесе таза ванадийдің қосылыстары және ванадий металы алынады.
Ванадий кендерін өңдеу үшін әр түрлі ыдырау әдістері қолданылады, олардың ішінде қышқылдармен немесе сілтілермен ыдырату.
Сілтілермен ыдыратқанда ванадий ерітіндіге алмасады, бірақ ерітіндіде ванадиймен бірге алюминий мен кремний болғандықтан оларды бөлу керек.
Ванадийдің шикізаттарын өңдегенде кең тараған әдіс — натрий хлориді қатысында күйдіру. Табиғаттағы қосылыстарда және шлактарда ванадий үш валентті күйде болады. Күйдіргенде ванадий бес валентті күйге дейін тотығып, ванадий оксидін V2O5 түзеді. Натрий хлоридінің ролі — ванадий оксидін натрий ванадатына айналдыру.
Ванадийді шөгінді кендерден алу
Ванадийдің негізгі көздері - темір кендері. Ең маңызды технологиялық операция - ванадийдің ерітінділерін фосфордан бөлу. Фосфордан бөлу үшін ерітінділерді аммиакпен бейтараптандырып, кальцийді тұнбаға Са3(РО4)2 түрінде түсіреді, ванадий аммоний ванадаты түрінде ерітіндіде қалады.
Ванадийді ерітіндіден немесе кальций ванадаты түрінде, кальций гидроксидін немесе кальций хлоридін қосып тұнбаға түсіреді. Немесе аммоний ванадаты ерітіндісіне жайлап күкірт қышқылын қосу арқылы ванадий оксидін тұнбаға түсіреді:
2NH4VO3 + H2SO4 → V2O5↓ + H2O + (NH4)2SO4
Ванадийді титаномагнетиттерден алу
Титаномагнетит — комплексті шикізат, одан темірді, титанды және ванадийді алуға болады. Басқа кендермен салыстырғанда титаномагнетитте ванадийдің мөлшері жоғарылау және фосфор жоқ. Сондықтан титаномагнетиттер өнеркәсіпте ванадийді алу үшін пайдаланылады.
Титаномагнетиттерді үш жолмен өңдейді:
а) тура тотықсыздану;
б) химиялық әдіс;
в) металлургиялық өңдеу арқылы ванадийді шламдардан бөлуі.
Ең көп пайдаланылатын — металлургиялық әдіс. Бұл әдісте ванадийдің шойындары және шлак алынады. Ең соңында шлакты химиялық әдістермен өңдейді.
Феррованадийді алу
Феррованадий ванадий оксидінен V2O5 немесе кальций ванадатынан феррокремниймен (силикотермиялық әдіс) немесе ұнтақ алюминий металымен (алюминотермиялық әдіс) тотықсыздану арқылы алынады /242, 290/.
Ванадий металын алу
Ванадий металы әр түрлі әдістермен алынады. Мысалы, ванадий оксидін тотықсыздандыру арқылы. Тотықсыздандырғыш ретінде кальций металын пайдаланады. Тотықсыздану процесін герметикалық болаттан жасалған ыдыста (бомба) өткізеді. Бірақ бұл әдіспен таза ванадийді алу үшін бастапқы материалдарды тазалау керек және кальцийдің артық мөлшерін пайдалану керек. Бұл әдіс күрделі және қымбат болғандықтан өнеркәсіптік салада аз пайдаланады.
Басқа әдіс — хлорид әдісі. Бұл әдісте ванадий металын үш хлорлы ванадийді магний металымен тотықсыздандыру арқылы алады ("Кролль әдісі"). Бастапқы материал ретінде феррованадий (ванадийдің мөлшері 80%) пайдаланады. Арнайы қондырғыда феррованадийге газды хлор қосып сұйық VC14 алынады, сосын оны қайнатады. Инертті газ жіберіп (мысалы, СО2), осы жағдайда VC14 үш хлорлы ванадийге VC13 айналады:
2VCl4 → 2VCl3 + Cl2
Үш хлорлы ванадий қатты зат түрінде бөлінеді.
Үш хлорлы ванадийді аргонның атмосферасында болатты ыдыста балқытылған магний металымен тотықсыздандырады:
2VCl3 + 3Mg → 2V + 3MgCl2
Ванадий металы губка түрінде бөлінеді, оның тазалығы 99,5%. Магний металының және магний хлоридінің қалдықтарын сумен жуып және вакуумдық дистилдеу арқылы ванадийден бөледі.
Бірінші әдіспен салыстырғанда ванадий металы таза болып алынады.
Аса таза ванадий йодид әдісі арқылы алынады ("Ван-Аркельдің әдісі"). Ванадий бұл әдісте 800-900°С температурада термиялық диссоциация арқылы ванадий йодидінен алынады:
2VI3 → t 2V + 3I2
Ванадий металы 1400°С температураға дейін қыздырған вольфрам сымында бөлінеді.
Электролиттік әдіспен ванадий бөлінбейді.
Ванадийдің технологиясы туралы келесі монографиялардан қарастыруға болады:
Аналитикалық сипаттамасы
Силикаттарды және тау кендерін анализдегенде кремний қышқылын бөлсе ванадий төрт валенттік күйге дейін тотықсызданады, ал басқа металдар ерітіндіде қалады. Аммиакты қосқанда ванадий темірмен тұнбаға түсіп, бес валентті күйге дейін тотығады. Қышқыл ерітіндіде күкіртсутекті қосқанда ванадий төрт валентті күйге дейін тотықсызданып ерітіндіде қалады. Осындай ерітіндіге аммоний сульфидін қосқанда тұнбаға аз еритін ванадийдің оксисульфиді VOS түседі. Аммоний сульфидін бес валентті ванадий ерітіндісіне қосқанда қызыл-шие түсті суда еритін ванадийдің сульфо-тұздары түзіледі. Бұл реакция арқылы ерітіндіде бес валентті ванадийді анықтауға болады — сапалық реакция.
Қышқылды ортада бес валентті ванадийге өзіне тән тотықсыздану реакциялары пайдаланады, тотықсыздандырғыш ретінде: күкіртті оттек SО2, қалайы хлориді, екі валентті темірдің ерітінділері, аммоний роданиді, теріс потенциалды металдар және олардың амальгамалары қолданылады. Төменгі валенттікке дейін тотықсызданғанда ерітіндінің түсі өзгереді, соған қарап ванадийдің тотықсыздану процесін байқауға болады.
Төрт валентті ванадийдің аналитикалық реакциялары толық В.И.Кузнецовтың және Л.С.Козыреваның жұмыстарында келтірілген /260/.
Ванадийдің сандық мөлшерін анықтауда ең белгілі әдістер — титриметрлік және фотометрлік. Гравиметрлік әдістер аз пайдаланылады. Гравиметрлік әдісте ванадийді тұнбаға түсіру үшін қорғасынның және сынаптың тұздары және оксихинолин немесе купферон пайдаланады.
Фотометрлік әдістердің ішінде кең тараған екі реакция: пероксидпен түзілетін қызғылт-сары түсті және сары түсті фосфор вольфрам ванадий комплексті қосылыстар. Ванадийді органикалық реагенттерді /292/ пайдаланып фотометрлік әдіспен анықтауға да болады. Ванадийді ферроцианидпен анықтауға болады: ванадийдің және ферроцианидтің арасында тотығу-тотықсыздану реакциясы өтіп, көк түсті ферриванадил VO3[Fe(CN)6]2 түзіледі:
NaVO3 + K4[Fe(CN)6] → VO3 [Fe(CN)6]2 + NaK3[Fe(CN)6];
V(V) + Fe(II) → V(IV) + Fe(III)
Төрт валентті ванадий йодидтің және калий йодатының арасындағы тотығу-тотықсыздану реакцияны катализдейді, осы реакцияны ванадийдің аз мөлшерін анықтау үшін (5-50 мкг) пайдаланады. Ванадийдің мөлшерін реакция арқылы бөлінген йодтың мөлшерімен анықтайды.
Ванадийді алюминийде анықтау үшін оны органикалық ерігіштермен диэтилдитикарбомат түрінде экстракциялайды, сосын азот қышқылын және пероксидті қосып, фотометрлік әдіспен анықтайды.
Молибден мен ванадийді бөлу үшін хроматографиялық әдісті пайдаланады.
Болаттарда және шойында ванадийді титриметрлік әдіспен анықтайды, бұл әдіс бес валентті ванадийдің Mop тұзын (FeSO4·(NH4)2SO4) қосқанда тотықсыздану реакциясына негізделген. Осы әдісте ванадийді Mop тұзымен тура титрлеуге болады немесе Mop тұзының артық мөлшерін қосып, сосын екі валентті темірдің мөлшерін аммоний персульфатымен ((NН4)2S2О8) тотықтырады, тотықсызданған ванадийді перманганатпен титрлейді. Бұл әдісте титрлеудің соңғы нүктесін индикатордың көмегімен — фенилантранил қышқылы немесе потенциометрлік әдіспен анықтауға болады. Титрлеудің соңғы нүктесін амперометрлік әдіспен де анықтауға болады. Титрлеуді платина электродында екі валентті темірдің тотығуы электр тоғы потенциалы + 1,0В тең болғанда өткізеді. Амперометрлік әдісті екі индикаторлы электродтарды пайдаланып өткізуге де болады.
Ванадийді қолдану
Ванадийдің техникада маңызы өте зор. Алдымен ванадий ерекше болаттар өнеркәсібінде пайдаланылады. Ванадийдің қатысында болаттың құрылысы ұсақ дәнді және біртекті болады, жабысқақтығы жоғарылайды, барлық механикалық қасиеттері жақсартылады, балқыту қасиеттері жоғарылайды.
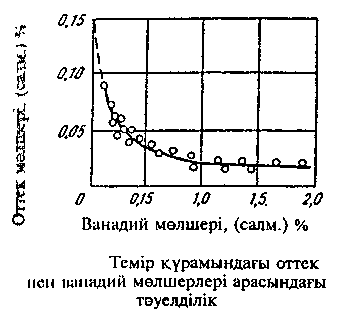
Ванадий сонымен қатар болаттағы оттектің мөлшерін төмендетеді. Темірдегі оттектің мөлшері ванадий мөлшерінің өсуімен 7 суретте келтірілген қисық бойынша өзгереді. Ванадийден күштірек мұндай қасиет тек кремнийде ғана бар.
Ванадийдің әр түрлі құймалары және олардың қасиеттері туралы У. Ростокердің монографиясында жазылған.
Ванадийді және оның құймаларын ядролық реакторда пайдаланады, себебі ванадийдің балқу температурасы және басқа балқымаларға тұрақтылығы жоғары.
Ванадий активті катализатор болғандықтан химиялық өнеркәсіпте маңызы зор. Күкірт қышқылы алынғанда ванадий катализаторы (V2O5) пайдаланады. V2O5 – катализатор ретінде әр түрлі органикалық химиядағы реакцияларда пайдаланылады.
Әдебиеттер тізімі:
1. Ферсман А.Е. Редкие металлы. 1932, № 4-5.
2. Сажин Н.П., Меерсон Г.А. Редкие элементы в новой технике // Хим. наука и пром., 1956. Т.І, № 5.
3. Меерсон Г.А. и Зеликман А.Н. Металлургия редких металлов. Метиаллургиздат, 1954.
4. Зеликман А.Н., Самсонов Г.В., Крейн О.Е. Металлургия редких металлов. Металлургиздат, 1954.
5. Тронов В.Г. Кклад русских ученых в химию редких элементов. Изд. Знание, 1952.
6. Виноградов А.П. Геохимия редких и рассеянных химических элементов в почвах. Изд. АН СССР, 1950.
Әлеуметтік желілерде бөлісіңіз:
Пікірлер (0)
Пікір қалдырыңыз
Қарап көріңіз
Басқа да жазбалар
- Жастар және ақпараттық тәуелділік: цифрлық әдеттер
- «Мәдениет және тұрмыс» журналы: ұлттық рухани кеңістіктің айнасы
- Міндетін өтеп, өмірін жоғалтқандар
- Тұрмыстық зорлық-зомбылыққа бейім ер клиенттермен психологиялық жұмыс
- Тұрмыстық зорлық-зомбылыққа бейім ер клиенттермен психологиялық жұмыс
- Бүйрек,бүйрекүсті безінің анатомиялық құрылымы, морфологиясы, гормондық қызметі және клиникалық маңызын талдап, жүйелеу.
- Бүйрек,бүйрекүсті безінің анатомиялық құрылымы, морфологиясы, гормондық қызметі және клиникалық маңызын талдап, жүйелеу
- Көшелердің аттарын өзгерту туралы
- Отбасылық қатігездікке ұшыраған әйелдер мен балалар проблемасы аясындағы фильмдерге талдау.
- Отбасында ер адамға қатыгездік. Б.Лукалдың конструктивтік концепция теориясына сүйене отырып отбасында ер адамға (күйеуіне) қатыгездік себептерін талдау
- Отбасында ер адамға қатыгездік. Б.Лукалдың конструктивтік концепция теориясына сүйене отырып отбасында ер адамға (күйеуіне) қатыгездік себептерін талдау.
- Отбасындағы ер адамға қатысты қатыгездік: Б.Лукальдың конструктивті тұжырымдамасы арқылы талдау
- Шоқан Уәлихановтың 190 жылдығына орай:ағартушылық идеялары мен ғылыми мұрасы
- Агрессия теориясы. Инстинкт (теория З.Фрейда, К. Лоренца), ынталандыру (Берковиц теориясы); қозу теориясы (теория переноса возбуждения Зильманна), оқу (теория А.Бандуры)
- Агрессия теориялары


- Конфуций
- Конфуций
- Эдвард Дж. Стиглиц
- Нельсон Мандела
Барлық авторлар
Ілмек бойынша іздеу
Мақал-мәтелдер
Қазақша есімдердің тізімі