Сирек элементтер. Цирконий және гафний
Оңтүстік Қазақстан обылысы
Шардара ауданы
№ 16 колледж
Орындаған: Тұ-43 топ студенті Мухамадеева Зарина Фаридовна
Жетекшісі: Айтенова Нұргул Ыдырысқызы
Жоспар:
1. Тарихи мағлұматтар
2. Қасиеттері. Олардың қосылыстары
1. Цирконий мен гафний периодтық жүйенің ІV тобына титанның топшасына кіреді.
Цирконий 1789 жылы М.Кларпорт (германия) циркон деген минералды ашты. Цирон өте ертеде белгілі болды, оның аталуы әр түрлі – гиацинт, яцинт, яргон. Оның өте әдемі түсіне және мөлдірлігіне байланысты әр түрлі әшекей ретінде пайдаланылды.
1923 жылы гафнийді циркон (Скандивания) минералынан Д.Хевеши, Д.Костер (Дания) ашты. Гафний деп аталуы Копенгаген деген Скандиван қаласына байланысты (латынша "Наfnia").
Д.И. Менделеев периодтық жүйені құрағанда гафний әлі ашылмаған, сондықтан перидтық жүйеде белгісіз элементке бос орын қалдырылған, оның реттік нөмірі 72 деп анықталған. Цирконда циркониймен қатар жүрген жаңа осы элемент (N72) деп табылған.
2. Цирконий мен гафнийдің электрондық құрылысы келесідей: Zr - 2, 8, 18, 10, 2; Hf - 2, 8, 18, 32, 10, 2. Осыған байланысты тұрақты валенттілік күйі – төрт. 1 кестеде цирконий мен гафнийдің ең маңызды физикалық константалары келтірілген.
1 кесте
Цирконий мен гафнийдің физикалық константалары
|
Элемент |
Реттік номері |
Атомдық салмағы |
Тығыздық г/см3 |
Атомдық радиусы |
Балқу темпер.0С |
Қайнау Темп.0С |
|
Цирконий (Zr) |
40 |
91,22 |
6,5 |
1,60 |
1952 |
4340 |
|
Гафний (Hf) |
72 |
178,6 |
13,31 |
1,59 |
1977 |
4600 |
Балқу және қайнау температуралары металдардың тазалығына байланысты. Сыртқы түріне қарағанда металдар болатқа ұқсас, таза түрінде өте жұмсақ.
Цирконий мен гафний ядролық техникада маңызы олардың пайдаланылатын қасиеттері – жылы нейтрондар алу: цирконийдің нейтрондарды басып алуының көлденең қимасы өте аз – 0,18 барн., ал гафнийдікі 120 барн.
Екі металдың бірнеше табиғаттық изотоптар бар (Zr-7, Hf-6) және бірнеше қолдан істелген изотоптар, кейбіріне «таңбаланған атомдар» (радиоактивті индикаторлар) ретінде пайдаланады.
Металдардың химиялық активтлігі жоғары болғандықтан оларды таза түрінде алу өте қиын. Кәдімгі температуралы ауада олар өзгермейді, бірақ қыздырғанда оттек және азотпен әрекеттесіп, оксидтер мен нитриттер түзеді. Металдар сутекті жұтып нитриттер түзеді: Zr4Н, Zr2Н. ZrН, ZrН2.
Қышқылдардың цирконий мен гафнийге әсері жоқ, тек қана патша және фтор қышқылында ериді. Бірақ кейбір әрекеттесулерде – цирконийдің жай күкірт және концентрлі тұз қышқылында еруі көрсетілген.
Цирконий коррзияға жоғары тұрақтылық крсетеді. Цирконий (гафний) сілтілердің ерітіндісімен әрекеттеспейді, ал балқыған сілтілермен әрекеттеседі.
Оттекпен қосылыстары
Цирконий мен гафнийді ауада қыздырғанда тотығып, оксидтер түзеді. Цирконийдің жоғары оксиді - ZrО2, балқу температурасы 2700°С. ZrО2 үш кристаллды модификацияда болады, өзгеру нүктелері 1205°-1900°С, қайнау температурасы 4300°С. ZrО2 табиғатта боc күйінде кездеседі (минерал бадделеит).
Цирконийдің төменгі оксидтері Zr2О3 және ZrО белгілі. Гафний - НfO2 деген жоғары оксид түзеді, балқу температурасы 2990°С.
Цирконий мен гафнийдің оксидтері суда ерімейді. Оларға сәйкес гидраттарды екі жолмен алуға болады: кейбір тұздардың ерітінділерін гидролиздеу арқылы немесе тұздарға сілтілермен әсер ету арқылы. Бірінші жағдайда гидраттар түзіледі, олар матақышқылдарға сәйкес келеді, мысалы, ZrО(ОH) иемесс Н2ZrО3:
Zr(SО4)2 + ЗН2О → Zr(ОН)2↓ + 2Н2SО4;
екінші жағдайда — ортоқышқылдарға Zr(ОН)4 немесе Н4ZrO4
Zr(SО4)2 + 4NaОН → Zr(ОН)4 + 2Nа2О4.
Гидроксидтер амфотерлі қасиеттер көрсетеді.
ZnO2 және НfО2 күшті қышқылдарды қосып (жай қосу керек, қыздыру) немесе сілтілермен балқытып ерітуге болады:
ZrO2 + 2H2SO4 → Zr(SО4)2 + 2Н2О
ZrO2 + 2NaOH → Na2ZrO3 + Н2О
Комплексті қосылыстар түзілетін болғандықтан, оксидтер фтор қышқылында жақсы ериді.
Цирконий мен гафнийдің тұздары
Цирконий мен гафнийдің оксидтерін сілтімен балқытқанда цирконий мен гафний қышқылдарының (Н2ZrO3, Н2Hf O3) тұздары – цирконаттар мен гафнаттар (Ме2ZrO3, Ме2Hf O3) түзіледі:
ZrO2 + 2NaOH t→ Na2ZrO3 + H2O
HfO2 + 2NaOH t→ Na2HfO3 + H2O
Цирконий менгафнийдің оксидтері СаО, ВаО, SrО жоне МgО оксидтерімен әрекеттеседі, мысалы:
ZrO2 + CaO → CaZrO3
HfO2 + CaO → CaHfO3
Сирек жер элементтер оксидтерімен (лантан, самарий, неодим) әрекеттескенде цирконат түзіледі, құрамы Lа2Zr2О7.
ZrO2 және НfО2 кремний оксидімен балқығанда силикиттар түзеді.
ZrO2 + SiO2 → ZrSiO4
HfO2 + SiO2 → HfSiO4
Цирконий мен гафний силикаттары табигатта минерал түрінде кездеседі: ZrSіО4 — циркон, HfSіО4 — гафнон.
Циркон (ZrSіО4) содамен немесе натрий гидроксидімен әрекеттескенде натрий цирконосиликаты түзіледі Nа2ZrSіО5 немесе ZrSіО4·Nа2О — ақ ұнтақты зат, суда ерімейді, минералды қышқылдарда жақсы ериді.
Цирконий мен гафнийдің оксидтері қышқылдарда ерігенде тұздар түзіледі:
ZrO2 + 2H2SO4 → Zr(SO4)22H2O
HfO2 + 2H2SO4 → Hf(SO4)22H2O
Тұздар ерітінділерде оңай гидролиздеңеді, сондықтан бір мезгілде цирконийдің әр түрлі иондары болуы мүмкін: Zr4+ - цирконий-иондары, ZrО21 - цирконил-иондары, сонымен қатар гидратты түрлері. Цирконий (IV) ерітіндіде полимер түрінде болуы мүмкін, полимерлену дәрежесі цирконийдің концентрациясы мен рН-на байланысты. Бұл байланыс 1 суретте керсетілген.
Осы байланыстан көретініміз: цирконийдің концентрациясы мен рН-ы жоғары болса — полимерлену дәрежесі де жоғарылайды. Комплекс түзуші реагенттерді қосқанда, мысалы, фтор қышқылын, полимерлер бұзылады.
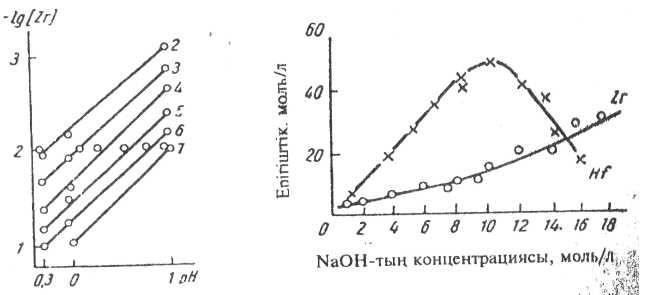
1 сурет - Цирконий иондарының полимерлену факторының концентрациясынан және ерітіндінің рН-нан тәуелділігі (сызықтар жанындағы сандар полимерлену факторына тең)
2 сурет - Цирконий мен гафний гидроксидінің натрий гидроксидінде ерігіштігі
Цирконий мен гафнийдің тұздарына аздап сілті қосса немесе гидролиздену реакциясын өткізсе, тұнбаға негізгі тұздар түседі, біртіндеп гидроксидтерге ауысады. Цирконий мен гафнийдің гидроксидтері натрий гидроксидтерінде ериді.
Бұл суреттен гафний гидроксидінің ерігіштігі цирконий гидроксидінен жоғарылау екенін байқауға болады. Натрий гидроксидінің максимумына жетіп (12 моль/л) гафний ерігіштігі төмендейді. Осы жағдайда натрий гидроксогафнаты Nа2Нf(ОН)6 түзіледі, бұл зат қатты фаза түрінде бөлінген.
Еріген комплексті қосылыстардың жалпы формуласы Ме(ОН)4+nn- (Me – циркоий мен гафний), олардың тұрақсыз константалары келесідей: Zr(OH)5 – 1,9*10-5 , Hf(OH)5 – 1,1*10-5 .
Гироксидінің ерігіштік көбейтіндісі: Zr(OH)4 – 3*10-26 , Hf(OH)4 -4*10-26.
Цирконий мен гафнийдің фосфаттары және ферроцианидтері
Цирконий мен гафний нашар еритін фосфаттар түзеді және Zr3(РО4)4. Бұл фосфаттар қышқыддарда ерімейді, сондықтан цирконий мен гафнийді басқа металдардан бөлуге болады.
Цирконий мен гафний аз еритін ферроцианидтер түзеді. Ферроцианидтердің құрамы оның концентрациясына және цирконий тұздарының гидролизіне байланысты.
Цирконий оксихлоридіне натрий феррацианидін қосса, құрамы [ZrО(ОН)]4[Ғе(СN)6] қосылыс түзіледі, ал калий феррацианидін қосқанда ZrО/ZrO(ОН)/2/Ғе(СN)6/ қосылыс түзіледі. Гидролиз болмағанда қышқылды ортада нормальды форроцианид құрамы Zr[Ғе(СN)6]-6Н2О түзіледі.
Пероксидті қосылыстары
Цирконий мен гафнийдің тұздарына сілтілі ортада пероксид сутекті қосқаңда, пероксидті қосылыстар түзіледі — надқышқылдар, оларды бос түрінде түссіз тұнба ретінде бөлуге болады. Надқышқылдар сутек пероксиді сияқты күшті тотықтырғыштар.
Галогендермен қосылыстары
Цирконий мен гафний қыздырғанда галогендермен әрекеттеседі.
Цирконий фториді ZrҒ4 цирконий металын фторсутекпен қыздырғанда алынады. Әдетте ZrҒ4 цирконий оксидіне фторид сутегін қосу арқылы немесе цирконий тұздарын ерітіндіден ZrҒ4·nН2О түрінде алынады:
ZrO2 + 4HF → ZrF4 + 2H2O
Zr(SO4)2 + 4HF → ZrF4
ZrF4 – ақ түсті зат, 800-10000С ұшады, суда қиын ериді (14л/л), фтор қышқылында комплексті қышқыл түзіп, жақсы ериді:
ZrF4 + 2HF → H2[ZrF6] + 2H2O
HfCl4 комплексті қосылысты (NH4)2HfF6 термиялық диссоциялану арқылы алынады:
(NH4)2HfF6 → HfF4 + 4NH4F
Цирконий мен гафнийдің хлоридтері металдардың хлормен қыздырғанда немесе металдардың оксидтерінің (көміртек қатысында) хлормен әрекеттесуі арқылы алынады.
ZrCl4 – ақ түсті ұшқыш кристалды зат, су қосқанда толық гидролизденеді:
ZrCl4 + 2H2O → Zr(OH)4 + 4HCl
Сондай-ақ басқа галогендерді қыздырғанда менталдармен әрекеттеседі. Технологияда және aнaлитикалық химияда иодидтер пайдаланады.
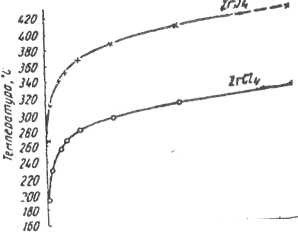
3 сурет - цирконий хлориді мен иодидінің булары қысымының температурадан тәуелділігі
ZrCl4 - ақ түсті, ұшқыш кристаллды зат.
ZrІ4 - сары түсті кристаллды зат, балқу температурасы 499°С (қысым жағдайында). Қыздырғанда цирконий иодиді айдалады.
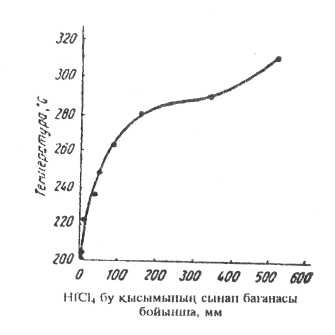
Цирконий мен гафнийді таза металл күйінде алу үшін иодидтер пайдаланылады. Металдар таза күйінде термиялық диссоциация әдісімен алынады:
ZrI4 t→ Zr + 2І2
Hf I4 t→ Hf + 2І2
Комплексті фторидтердің және комплексті хлоридтердің тәжірибеде маңызы зор.
Олар "Комплексті қосылыстар" деген бөлімде қарастырылады
Хлоридтер органикалық заттармен бірқатар күрделі Қосылыстар береді, мысалы, спирттермен, пиридинмен. Цирконий хлоридіне белгілі этил-, метил-, фенилбензоаттар, гафний хлоридіне — этил-, метилбензоаттар. Бұл заттар су қосқанда ыдырап, тетрахлорид және эфир береді, осы қасиетті пайдаланып, цирконий мен гафнийді басқа элементтерден бөлуге болады.
Цирконийге сонымен қатар белгілі оксихлорид, мысалы ZrOCl — цирконилхлорид, цирконий хлориді сумен әрекеттескенде түзіледі:
ZrС14 + Н2О → ZrОС12 + 2НСІ
ZrОС12 молекуласы 8 су молекуласымен кристалданады. Суда жақсы ериді, концентрлі тұз қышқылында қиын ериді /479/. ZrОС12-8Н2О 45-650С температураға дейін қыздырғанда су бөлінеді, ал 80°С температурада ыдырап хлор бөлінеді, ал 400 – 4500С температурада ZrО2 бөлінеді.
Егер белгілі рН-та оксихлорид ерітінділеріне сульфат иондарын қосса (натрий, алюминий, темір, аммоний сульфаттарының ерітіндісі) цирконийді негізгі сульфаттар түрінде тұнбаға түсіруге болады.
Цирконий мен гафнийдің дигалогенидтері алынған. Цирконий тетрахлоридін цирконий металы қатысында қыздырғанда қара түсті дихлорид түзіледі:
ZrС14 + Zr → 2ZrCl2
Ал ZrС14 ауасыз ортада 350°С температурада алюминий металымен тотықсыздандырғанда қызыл-қоңыр түсті ZrС13 түзіледі, одан әрі қыздырса диспроспорциялану процесі өтіп ди- және тетрахлорид түзіледі:
2ZrС13 ↔ ZrС12 + ZrСІ4
Дәл осындай реакциялар, цирконий мен гафиийдің бромидтермен және иодидтермен өтеді.
Комплексті қосылыстары
Цирконий мен гафний комплексті галогенидтер береді құрамы Ме2ZrГал6 (Ме — бір валентті металл, Гал. – галоид).
Комплексті галогенидтер тұрақты, ең маңыздысы, калий фторцирконаты К2ZrF6, технологияда және анализде пайдаланылады. Гафнийдің алюминий фторгафнаты (NH4)2HfF6 ерігіштігі жоғары болғандықтан оны цирконийден бөлу үшін пайдаланады. Келесі комплексті қосылыстар белгілі: Rb2Zr(Нf)Ғ6, Сs2Zr(Нf)Ғ6, Т12Zr(Нf)Ғ6, АgZr(Нf)Ғ6.
Фторцирконаттар цирконийді алу үшін пайдаланылады, сондықтан толық зерттелген.
465°С температураға дейін қыздырғанда К2ZrҒб ыдырап, КҒ және ZrҒ4 бөлінеді:
КZrF6 → 2KF + ZrҒ4
600°С температурада ауада ZrО2 түзіледі. Цирконий фториді комплексінің тұрақсыз константасы 10-9.
Сонымен қатар цирконий мен гафнийдің гексахлоридтері белгілі, сыртқы сфeрасында әр түрлі сілтілі металдар бар олар: натрий, калий, рубидий, цезий. Жоғары температурада ыдырау реакциясы өтеді:
Ме2ZrСІ6 ↔ 2МeС1 + ZrСІ4
Цирконий мен гафнийге комплексті сульфаттар белгілі, сонымен бірге цирконий комплексінің тұрақтылығы гафнийден жоғарылау /38/. Күкірт қышқылды ортадан цирконий сульфаты түссіз цирконил күкірт қышқылы кристалл түрінде бөлінеді, гидролиз өткенде негізгі сульфаттар бөлінеді. Осы қосылыстарды комплексті қосылыстар деп қарастыруға болады, мысалы Н4[Zr(ОН)2(SО4)6] · 4Н2О.
Цирконилкүкірт қышқылдың түзілуін және гидролиздену реакциясын пайдаланып тәжірибеде цирконийді ерітіндіден бөледі.
Күкірт қышқылының жоғары концентрациясында басқа зат түзіледі — цирконий үшсульфаты Н2[Zr(SО4)3] · 3Н2О.
Цирконий нитраты бірнеше комплексті қосылыстар береді, олар әр түрлі азот қышқылдық ортада түзіледі: азот қышқылының нормальдық концентрациясы 0,3 төмен болса, онда цирконий гидроксиді тузіледі - Zr(ОН)4, қышқылдың концетрациясы жоғарыласа жоғары полимерлі молекулалар түзіліп [Zr2О3]2+ иондар пайда болады, соңғысында келесідей комплексті иондар түзіледі: [Zr(ОН)2NО3]+, [Zr(ОН)2(NО3)2]°, Zr(NО3)2]2+, [Zr(ОН)2(NО3)4]2-.
Цирконий мен гафний қымыздық қышкылмен комплексті қосылыстар береді, оның формуласы [Мо(С2O4)4]4- (Ме — цирконий немесе гафний). Бұл комплекс тұз кышқылды ерітіндіде металмен оксалат ионның қатысымен Ме:С2О42- 1:25-тен 1:100-ге дейін болғанда түзіледі. Ал оксалаттың концентрациясы жоғары болғанда (рН мәні 5,8-ден 6,2-ге дейін) келесі комплекс түзіледі — [Ме(С2О4)5]6-. Комплекстің тұрақты константасы 1036. Басқа жұмыста көрсетілген тағы үш тұрақты оксалат комплекстің түзілуі, тұрақсыз константалары есептелген:
ZrC2O42+; (K = 1,6·10-10); Zr(C2O4)2 (K = 4,6·10-8); ZrO C2O4 (K = 2,1·10-7)
Цирконий мен гафнийдің басқа көп органикалық реагенттермен комплексті қосылыстарын технологияда және анализде пайдаланады /493-499/. Мысалы цирконий лимон қышқылымен калий гидроксиді қатысында калий цитратоцирконилоат түзеді, құрамы К3[ZrO(С6Н5О7)2Н]·8,5Н2О, спирт қосқанда тұнбаға түседі.
Бормен, көміртекпен, кремниймен, азотпен және фосформен қосылыстары
2 кестеде цирконий мен гафнийдің қосылыстарының құрамы және маңызды физикалық қасиеттері келтірілген.
Осы ксстеден цирконий мен гафний барлық қосылыстарында жоғары балқу температураға және жоғары электрөткізгіштік қасиетіне ие екені байқалады. Келтірілген барлық қосылыстар хлордың атмосферасында ыдырайды, себебі хлоридтер түзіледі.
Боридтер келесі реакция бойынша қыздырғанда алынады:
7Zr + 3В4С + В2О3 → 7ZrB2 + 3CO
Нитриттер металдар азотпен немесе аммиакпен әрекеттескенде алынады /204/. Силициттерді әр түрлі жолмен алады:
2 кесте
Цирконий мен гафний боридтерінің, карбидтерінің, силициттерінің, нитриттерінің және фосфидтерініңфизикалық қасиеттері
|
Қосылыстар |
Балқу темп. 0С |
Электрөткізгіштік үлесі |
Микроқаттылық |
|
ZrB2 |
3040 |
62500 |
2252 |
|
ZrB12 |
2680 |
16670 |
- |
|
HfB2 |
3250 |
98000 |
2900 |
|
ZrC |
3530 |
20000 |
2136-3480 |
|
HfC |
3890 |
22250 |
2913 |
|
ZrSi |
2150 |
13200 |
- |
|
ZrSi2 |
1700 |
13200 |
1063 |
|
Zr2Si |
2220 |
- |
- |
|
Hf5Si3 |
|
|
|
|
Hf2Si |
2250 |
- |
- |
|
ZrN |
2980 |
74400 |
1480 |
|
HfN |
2982 |
- |
1640 |
1) Элементтердің тура вакуум пеште әрекеттесуі;
2) 20000С температурада цирконий мен гафнийдің кремниймен әрекеттесуі, сосын 1500-18000С температурада сутек атмосферада жандыру;
3) Алюминотермиялық тотықсыздандыру;
4) Сілтілі металдың фторсиликатының балқымасы электролиздеу.
Цирконий мен гафнийдің карбидтері оксидтерді көміртек пен сутек немесе көміртек оксидімен 2000°С температурада пеште күйдіру арқылы алынады. Бұл тотықсыздану процесін жалпы келесі реакция арқылы көрсетуге болады:
ZrO2 + ЗС → ZrС + 2СО
Сонымен қатар цирконий фосфидтері: α-, β-монофосфидтері ZrР және дифосфиді ZrР2 белгілі, олар элементтерден синтeз арқылы қыздырғанда (қысым) немесе 750°С температурада ZrCl4 + РН3 қоспаны қыздырып, одан әрі 850°С температурада фосфинді металмен әрекеттескенде алады. Осыған ұқсас гафний фосфиді белгілі.
Күкіртпен қосылыстары
Сульфидтер, құрамы МеS2 элеметтерді қыздырғанда бір-бірімен әрекеттесіп немесе 6000С температурада күкіртсутек хлоридімен әрекеттесу арқылы алынады. Цирконий мен гафний тұздардың ерітінділеріне күкіртсутек қосқанда тұнба түзілмейді.
ZrS2 - қара-қоңыр ұнтақ, ауада тұрақты, суда ерімейді, қыздырғанда оксид түзіледі.
Электрохимиялық сипаттамасы
Сулы ерітінділерде цирконий мен гафний тек қана төрт валентті күйде болады. Төменгі валенітік күй тек қана галогенидтерге және оксидке ZrO тән. Сондықтан ерітіндіде тотығу-тотықсыздану реакциялар өтпейді.
Келесі реакцияның Ме4+ → Ме нормальдық потенциалдың шамасы цирконийге — 1,56В, гафнийге — 1,7В. Цирконий мен гафнийдің қосылыстардың металға дейін тотықсыздануы тек қана фторид немесе хлорид комплексті қосылыстардың балқымасында өтуі мүмкін.
Минералдары мен кендері
Цирконий ванадий сияқты кең тараған сирек элементтерге жатады. Жер қыртысында таралуы бойынша цирконий 19-шы орын алады, IV декадаға жатады. Цирконийдің кларкі 0,025, гафнийдің кларкі 4-10-6 (VI декада). Цирконийдің ең маңызды минералдары келесілер:
Бадделеит (немесе бразилит) ZrО2, бай кені Бразилиада кездеседі.
Циркон ZrSіО4 (арабша "zerk" - асыл тас). Цирконның әр түсті түрлері гиацинт деп аталады. Минералдың ірі кені Австралияда, Индияда, Норвегияда, Мадагаскарда, Цейлонда кездеседі. Кейбір циркондарда басқа сирек элементтер кездеседі: олардың ішінде — сирек жер элементтер, ниобий, тантал, торий, уран.
Эвдиалит — күрделі минерал, оның құрамы мына формуламен көрсетілген: (Na, Са) ZrSі6О17(О, ОН, С1). Минералдың түсі әр түрлі: қызғылт немесе қызыл-сұр. Минералда тантал, ниобий, сирек жер элементтер (церий, лантан, празеодим), иттрий, гафний кездеседі. Минерал кені Гренландияда, Норвегияда, Мадагаскарда кездеседі.
Гафний табиғатта өз минералдары түрінде сиректеу кездеседі, цирконийдің тұрақты серігі. Гафнийдің ең жоғары мөлшері цирконда.
Технологиясы. Концентраттарды ыдырату
Цирконий ядролық техникада пайдаланылатын болғандықтан, оны таза түрінде бөлу керек (гафний болмауы керек). Циркон концентраттарын ыдыратқанда үш әдіс пайдаланылады:
1) Карбид әдісі, осы әдіспен сусыз хлоридтер алынады, гафний экстракция арқылы бөлінеді.
2) Калий кремний фторидімен балқыту, сосын цирконий мен гафнийдің комплексті фторидтерінің фракциялық кристаллизациясы.
3) Натрий гидроксидімен балқыту, азот қышқылында еріту, гафнийді экстракция арқылы бөлу.
Бадделеитті басқаша өндейді.
Концентратты күйдіреді, сосын суда суытады, оның нәтижесінде минерал ұнтақ түрінде болады, алюминий және темірдің қоспаларын қышқылмен бөледі. Таза оксид керек болса бадделеитті күкірт қышқылымен қыздырып ыдыратады, ерітіндіден натрий гидроксидін қосып, цирконийдің гидроксидін тұнбаға түсіреді.
Кендердің құрамында титан болса, оны цирконийден бөлу үшін қос фторидтердің ерігіштіктерінің айырмашылығын пайдаланады: К2ZrҒ6-ның ерігіштігі (14г/л) титан фторидінің (К2ТіҒ6) ерігіштігінен жоғары.
Цирконий мен гафнийді бөлу
Цирконий мен гафнийдің қасиеттері өте жақын болғандықтан, оларды бір-бірінен бөлу өте күрделі мәселе.
Цирконий мен гафнийді келесі әдістермен бөлуге болады:
1) комплексті фторидтерді, оксалаттарды, фосфаттарды, хлороксидтерді, тағы басқа аз еритін қосылыстарды кристаллизация арқылы бөлшектеу.
2) Ионалмасу және адсорбциялық әдіс арқылы.
3) Органикалық ерігіштермен экстракциялау.
4) Цирконий мең гафнийдің тетрагалогенидтерінің буларын ректификациялау арқылы.
5) Ұшатын заттарды фракциялық дистилляция арқылы.
Осы әдістердің арасында ең маңыздысы — ионалмасу және экстракциялау әдістері. Мысалы цирконийді гафнийден ионалмасу әдісімен катионит КУ-2 пайдаланып бөлуге болады. Бұл әдісте катионитте цирконий мен гафний сорбциялайды, лимон қышқылын қосып, цирконийді жуып тастайды, соңынан қымыздық немесе күкірт қышқылын қосып, гафнийді жуып бөледі.
Цирконий мен гафний металдарын алу
Қазір бүкіл цирконий металы цирконий хлоридінен ZrСl4 магаиймен тотықсыздандыру арқылы алынады. ("Кроль әдісі"). Тотықсыздану процесі 900°С температурада өтеді.
Өте таза цирконий иодидтердің термиялық диссоциациясы арқылы алынады - "иодидті әдіс". Осы процесте қайтымды реакция өтеді:
Zr + 2I2 ↔ ZrI4
Әдістің жолы келесідей: "шикі" (тазаланбаған) цирконий металы жоғары температурада (300-350°С) вакуумда иодпен әрекеттесіп иодид түзеді. Иодид жоғары температурада (1400"С) қыздырған вольфрам сымына қонып, диссоциацияланып цирконий мен бос иодқа ыдырайды.
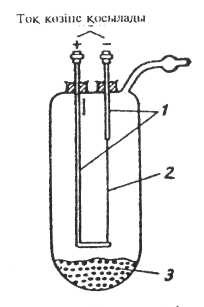
4 сурет - Цирконийді иодидті әдіспен алу құралаының сызбанұсқасы:
1- вольфрамды өзек, 2-вольфрамды жіп, 3-шикі цирконий мен иодтың қоспасы
Цирконийді алудың басқа да әдістері бар: цирконий оксидін ZrО2 кальциймен, магниймен, алюминиймен, көміртекпен т.б. тотықсыздандыру; ZrCl4-ті натриймен немссе кальциймен тотықсыздандыру, цирконий фторидін немесе фторцирконатты натриймен немесе алюминиймен тотықсыздандыру.
Гафний цирконий сияқты Кролль әдісімен алынады.
Аналитикалық сипаттамасы
Цирконий. Сапалық реакцияларда бірнеше органикалық қосылыстар пайдаланады: парадиметиламиноазофениларсон қышқылы, цирконийдің қатысында қызыл-сұр түс пайда болады, кармин қышқылы (күлгін түсті тұнба) және ализаринсульфонат (ализарин 8) (қызыл түсті тұнба). Ализаринсульфонат цирконий мен гафнийге спецификалық сезгіш реагент. Осы реагентті пайдаланып элементтерді фотометрлік әдіспен анықтауға болады.
Цирконийдің гравиметрлік әдістердің ішінде ең көп пайдаланылатыны — фосфат әдісі. Бұл әдіс қышқылды ортада нашар еритін цирконий фосфатының түзілуіне негізделген.
Сонымен қатар цирконийді басқа әдістермен анықтайды — иодат, селенді қышқылмен, органикалық реагенттермен. Иодат әдісте цирконийді калий иодатымен қос тұз 2Zr(IOз)4·КIOз·8Н2О түрінде тұнбаға түсіреді, сосын тұнбаны тұз қышқылында ерітеді, бөлінген бос иод (калий иодидін қосқанда) тиосульфатпен титрлейді.
Селенді қышқылды пайдаланғанда цирконийді селенит түрінде тұнбаға түсіреді, күйдіргенде таза оксид к,алады — ZrО2.
Цирконийді купферронды пайдаланып толық тұнбаға түсіруге болады. Тұнбаны күйдіріп болған соң таза цирконий оксиді белінеді.
Цирконийді фениларсон қышқылын пайдаланып тұнбаға түсіруге болады. Тұнбаның құрамы ZrО(С6Н5АsО3Н)2, күйдіргенде ZrО2 бөлінеді. Тұнба түсіргіш ретінде миндаль қышқылы (С6Н5СНОН СООН) пайдаланылады, күйдіргенде таза ZrО2 бөлінеді.
Жаңа реагенттердің арасында тиомалеин қышқылы СООН·СНН·СН3СООН туралы айтып кету керек. Бұл реагент өте селективті: цирконийді анықтағанда тек қана висмут кедергі жасайды.
Цирконийдің аналитикалық химиясында әр түрлі комплексондар пайдаланады, олардың ішінде комплексон III (трилон Б). Комплексондар титриметрлік әдістерде пайдаланады. Осы әдістің бірнеше түрлері бар - тура, кері, т.б. Титриметрлік әдісте титрлеудің соңғы нүктесін анықтау үшін амперометрлік әдіс пайдаланылады. Бұл әдісте комплексонның артық мөлшерін висмут нитраты ерітіндісімен платина электродын пайдаланып титрлейді.
Цирконийді купферронмен немесе фторидпен титрлейді. Титрлеудің соңғы нүктесін амперометрлік әдіспен анықтауға болады.
Цирконийдің аналитикалық химиясында органикалық реагенттер пайдаланады, олардың ішінде арсеназо-, ксиленолды қызыл-сары.
Цирконийді анықтау үшін сонымен қатар спектральды және басқа физикалық әдістер пайдаланады.
Гафний. Гафнийді объектілерде анықтау үшін спектралъды және басқа физикалық әдістер (рентеноспектральды, флуоресцентті, радиохимиялық) пайдаланады. Химиялық анализде гафний циркониймен қатар тұнбаға түседі. Гафнийді цирконий қатысында анықтау үшін кері әдістер пайдаланылады. Осындай әдістердің бірі келесідей: цирконийді гафниймен бірге тұнбаға бромминдаль қышқылымен түсіреді, тұнбаны күйдіріп оксидтсрдің (ZrО2+НfО2) массасын өлшейді. Гафний оксидінің проценттік мөлшерін мына формуламен есептейді:
%HfO2=274,2-33,4 кептірген тұнбаның миссасы/оксидтердің массасы
Цирконий мен гафнийді ионалмасу және адсорбциялық әдіспен бөлуге болады.
Гафнийді цирконийден триэтилфосфат көмегімен бөлуге болады, сонымен гафний тұнбаға бөлінеді, ал цирконий ерітіндіде қалады.
Кейбір фотометрлік әдістермен гафнийді цирконий қатысында анықтауға болады, мысалы арсеназомен әрекеттеседі, бірақ жоғары қышқылдық ортада (>1н) тек қана цирконий комплексінің түсі өзгермейді.
Гафнийді цирконийдің қатысында ксиленолды қызыл-сары көмегімен анықтауға болады. Спектрометрлік әдіспен 0,05-2% гафнийді цирконийдің қатысында анықтауға болады. Сонымен қатар радиоактивациялық әдісті пайдаланып, гафнийді цирконийдің қатысында анықтауға болады, осы әдіспен гафнийді цирконий металында анықтауға болады.
Гафнийдің аналитикалық химиясы туралы шолу мақалада толық жазылған.
Цирконий мен гафнийді қолдану
Цирконий мен гафний ядролық техникада пайдаланылады. Цирконий болаттарда қышқылдатқыш және реттеуші металл ретінде пайдаланылады. Цирконий басқа металдармен маңызы зор құймалар түзеді. Олардың арасында ең қызықты магний құймалары, оның құрамында цинк және цирконий бар: 4,5% 2л, 0,7% 2,г, 3% сирек жер элементтер. Осындай құймалар ең жақсы жоғары механикалық көрсеткіштер жене аз массалық үлесті көрсетеді, сондықтан авиатехникада пайдаланылады. Цирконий оксидін жоғары балқу температураға ие болғандықтан металлургиялық пештерде отқа төзімді материал ретінде пайдаланады. Цирконийді әр түрлі өндірісте пайдалану туралы келесі мақалада жазылған.
Гафний цирконий сияқты ядролық энергетикада, сонымен қатар электротехникалық және радиотехникалық (катодтар, контакттар) өндірістерде, металлургияда т.б. пайдаланылады. Гафний оксиді катализатор ретінде бутадиенді этил спиртінен алғанда, крекинг процесінде, т.б. каталитикалық процестерде пайдаланады. Гафний оксиді отқа төзімді өнімдерде пайдаланады.
Әдебиеттер тізімі:
1. Ферсман А.Е. Редкие металлы. 1932, № 4-5.
2. Сажин Н.П., Меерсон Г.А. Редкие элементы в новой технике // Хим. наука и пром., 1956. Т.І, № 5.
3. Меерсон Г.А. и Зеликман А.Н. Металлургия редких металлов. Метиаллургиздат, 1954.
4. Зеликман А.Н., Самсонов Г.В., Крейн О.Е. Металлургия редких металлов. Металлургиздат, 1954.
5. Тронов В.Г. Вклад русских ученых в химию редких элементов. Изд. Знание, 1952.
6. Виноградов А.П. Геохимия редких и рассеянных химических элементов в почвах. Изд. АН СССР, 1950.
Әлеуметтік желілерде бөлісіңіз:
Пікірлер (0)
Пікір қалдырыңыз
Қарап көріңіз
Басқа да жазбалар
- Жастар және ақпараттық тәуелділік: цифрлық әдеттер
- «Мәдениет және тұрмыс» журналы: ұлттық рухани кеңістіктің айнасы
- Міндетін өтеп, өмірін жоғалтқандар
- Тұрмыстық зорлық-зомбылыққа бейім ер клиенттермен психологиялық жұмыс
- Тұрмыстық зорлық-зомбылыққа бейім ер клиенттермен психологиялық жұмыс
- Бүйрек,бүйрекүсті безінің анатомиялық құрылымы, морфологиясы, гормондық қызметі және клиникалық маңызын талдап, жүйелеу.
- Бүйрек,бүйрекүсті безінің анатомиялық құрылымы, морфологиясы, гормондық қызметі және клиникалық маңызын талдап, жүйелеу
- Көшелердің аттарын өзгерту туралы
- Отбасылық қатігездікке ұшыраған әйелдер мен балалар проблемасы аясындағы фильмдерге талдау.
- Отбасында ер адамға қатыгездік. Б.Лукалдың конструктивтік концепция теориясына сүйене отырып отбасында ер адамға (күйеуіне) қатыгездік себептерін талдау
- Отбасында ер адамға қатыгездік. Б.Лукалдың конструктивтік концепция теориясына сүйене отырып отбасында ер адамға (күйеуіне) қатыгездік себептерін талдау.
- Отбасындағы ер адамға қатысты қатыгездік: Б.Лукальдың конструктивті тұжырымдамасы арқылы талдау
- Шоқан Уәлихановтың 190 жылдығына орай:ағартушылық идеялары мен ғылыми мұрасы
- Агрессия теориясы. Инстинкт (теория З.Фрейда, К. Лоренца), ынталандыру (Берковиц теориясы); қозу теориясы (теория переноса возбуждения Зильманна), оқу (теория А.Бандуры)
- Агрессия теориялары


- Конфуций
- Конфуций
- Эдвард Дж. Стиглиц
- Нельсон Мандела
Барлық авторлар
Ілмек бойынша іздеу
Мақал-мәтелдер
Қазақша есімдердің тізімі