Галлий, индий, таллийдің ферроцианидтерімен комплексті қосылыстары
Оңтүстік Қазақстан обылысы
Шардара ауданы
№ 16 колледж
Орындаған: Тұ-53 топ студенті Жалғасбай Дана Қайратқызы
Жетекшісі: Айтенова Нұргул Ыдырысқызы
Ферроцианидтері
Ферроцианидтерінің галлий, индий және таллийдің аналитикалық химиясында маңызы зор. Галий ферроцианидін Gn4[Fe(СN)6]3 ең алғаш Лекок де Буабодран алған, ол онымен галлийді қышқыл ерітінділерден бөлу үшін қолданған: 12%-ті тұз қышқылынан шамамен 10 мл-нен 0,1 мг Ga тұнады. Анализдің физика-химиялық тәсілдерін қолданып галлийдің ферроцианидпен әрекеттесуін И.В.Тананаев пен Н.В.Баусова жүргізген. Олардың анықтауы бойынша ферроцианид: галлий қатынасы 0,75-тен төмен болса жоғарыда көрсетілген қарапайым ферроцианид түзіледі. Егер ферроцианид мөлшері жоғары болса аралас тұздар түзіледі: MeGa[Fe(CN)6] (мұнда Ме - Na, К және Rb мен Cs). Erep литий болса кез келген қатынаста жай тұз түзіледі: Ga4[Fe(CN)6]3.
Тура сондай терең зерттеулер индийдің ферроцианидпен әрекеттесуіне де арналған. Натрий мен литий ферроцианидтері индиймен тек құрамы жай тұзға сәйкес қосылыс түзетіні анықталды: In4[Ғе(СN)6]3. Ал калий ферроцианидімен тұндырса (галлий сияқты) екі түрлі тұз түзіледі: егер ферроцианид: индий қатынасы 0,75-тен аспаса — жай тұз; егер ферроцианид мөлшері жоғары болса - қос тұз KIn[Fe(CN)6].
Қос тұздың тұрақтылығы жай тұзбен салыстырғанда жоғары.
Бір валентті таллий сілті металдар сияқты, яғни сілті металдар иондарымен аз еритін қос тұздар түзіп тұнбаға түседі: ТІ2Ме[Ғе(СN)6]. ТІ+ мыспен де аз еритін қосылыстар береді — TІ2Cu2[Fe(CN)6]2, никельмен де — TI4Ni4[Fe(CN)6]3, сонымен қатар кобальт, кадмий және мырышпен. Бұл тұнбалардың ерігіштігі төмен болғаны соншалық, егер бұл элементтердің ферроцианидтерінің суспензиясына таллий қосса, түсті металдың ионын таллий ығыстырады, яғни таллий ерітіндіден бөлінеді. Бұл жайды И.В. Тананаев пен М.А. Глушкова түсті металдар бар ерітінділерден таллийдің өтс аз мөлшерін (шамамен 0,01 г/л) ферроцианид арқылы бөлу үшін қолдануды ұсынды.
Таллий мен уранил де өте аз ерігіштікке ие (2,1∙10-5 моль/л) - TІ2(UO2)3[Fe(CN)6]2 және TІ4(UO5)4[Fe(CN)6]5, сонымен қатар таллий ферроцианидінің сирек жер элементтерімен аралас қосылыстары, мысалы лантанмен — TІLa[Fe(CN)6]4H2O. Егер ТI+ сілті металдармен салыстырса, ол TІ-Cs — Rb — К — Na — Li қатарын бастайтыны аңғарылады, яғни таллийдің аз еритін ферроцианидтер түзу қабілеті сілті металдардан жоғары.
Феррицианидпен галлий, индий және таллий тұнба бермейді.
Комплексті қосылыстары
Галлийге комплексті фторидтер түзу қасиеті тән, яғни фторогаллаттар, Олардың жалпы формуласы - Ме3(СаҒ)6, (мұнда Me — сілті металл). Бірақ қазіргі физика-химиялық әдістермен NaF:GaF3 қатынасы 3:1 емес, 2,6:1 екені және де натрий фторогаллатының формуласы 13NaF5GaF3 екені дәлелденді. Бұл тұздың судағы ерігіштігі 0,31%, осыған негізделіп галлийді комплексті фторид түрінде басқа ерігіш фторидтер түзетін элементтерден бөлуге болады.
Фторогаллаттардың құрамы катион табиғатына тәуелді: калий фторогаллатының құрамы K2(GaF55H2O), рубидий мен цезий фторогаллаттарының құрамы Me(GaF42H2O). Сулы ерітінділерде фторогаллаттар галлий фторидін және сілті фторидін түзу арқылы диссоциацияланады, ал галлий фториді әрі қарай GaF+2 ионын түзіп диссоциацияланады. Бұл ерітіндіде құрамында галлий бар басқа иондар табылмаған. Барий және стронций фторогаллаттарының құрамы Mе3(GaF6)2H2O.
Галлий галогенидтері әр түрлі органикалық заттармен, мысалы ортофенантролинмен комплексті қосылыс түзеді. Галлий хлориді фенантролин екі молекуласын, ал бромид пен иодид - үш молекуласын қосып алады. Бұл комплсксті қосылыстардың тұрақтылығы өте жоғары — галлий олардан аммиакпен де тұндырылмайды. Тура осындай комплекстер пиридинмен, нитробензолмен және т.б. көптеген құрамында азот бар органикалық заттармен алынған.
Т.В.Пермякова мен И.С.Лилеев рН 9,2-10 шамасында натрий галлаты мен натрий бикарбонатын әрекеттестіріп комплексті натрий галлокарбонатын Na2OGa2O32CO2rH2O алған. Бұл ұсақ кристалды ақ түсті ұнтақ зат, аздап ылғалтартқыш, қышқылдардан, сілтілерден, сонымен қатар су әсерінен де (қыздырса) оңай ыдырайды.
Галлий көптеген органикалық қышқылдармен де комплексті қосылыстар түзеді. Шарап қышқылымен галлий, тұрақтылығы алюминий комплексінен жоғары, комплексті қосылыс береді: егер алюминий катионының шарап қышқылды комплекстегі байланыс күшін 1-ге теңесек, онда галлийдің байланысуы: 111-ге тең болады; шарапқышқылды ерітінділерден галлий гидроксиді рН 2,5-ке тең болғанда тұндырыла бастайды, ал алюминий — 3,6. Қай элементтің гидроксиді ең аз ерігіш болса, сол элементтің шарапқышқылды комплексі тұрақтылау болады.
Оксалатты ерітінділерде жай оксалатпен Ga2(C2O4)3 қатар екі комплексті ион болады – [Ga(C2O4)2]- және [Ga(C2О4]3- олар рН мәні жоғарыласа тепе-теңдік комплексті оксалаттарға қарай ығысады, ал төмендесе жай оксалатқа қарай ығысады /1068/. Полярографиялық әдіспен рН 8,6-10-ға дейін [СIn(СаО4)3]3- комплексі болатыны дәлелденді, бұл комплекстің тотықсыздануының жартылай потенциалы (-1,58)÷(-1,60)-қа тең. Құрамы тура осындай комплекстер салицил қышқылының ерінділерінде де түзіледі. Сонымен қатар үшоксиглутар қышқылымен, оксихинолиммен, купфоронмен комплексті қосылыстары белгілі. Соңғы жылдары галлиймен қанық боялған түсті қосылыстар беретін органикалық заттар ұсынылған. Бұл заттардың галлийдің аналитикалық химиясында маңызы зор. Мысалы, родамин В және Ж, немесе "галлион" — оксихлораминонафталиндисульфо қышқылы.
Индий хлориді галлий хлориді сияқты, сілті металдармен Ме3InС162Н2О немесе Me2InCl5-H2О типтес комплексті тұздар түзеді, сонымен қатар аммиакпен және органикалық заттармен де комплексті қосылыстар береді. Индийдің көп комплексті қосылыстары аналитикалық химияда кеңінен қолданылады, мысалы оксихинолинмен, пирокатехинмен, хинализаринмен, әр түрлі азобояулармен комплексті қосылыстары /1050, 1058/.
Жоғарыда индийдің қос сульфаттары туралы аталған еді. Ол сонымен қатар құрамы H[In(SO4)2]3,5H2O-гe сәйкес комплексті сульфаттар түзеді. Бірақ индийдің комплексті сульфаттарының құрылымы және қасиеттері толық зерттелмеген. Оны индий сульфаттарының полярографиялық зерттеулері дәлелдеді.
Индий оксалаттармен әрекеттескенде, сатылап келесі комплексті қосылыстар түзіледі: (ІnС2О4)+, [Іn(С2О4)2]- және [Іn(С2О4)3]3-, Cs[In(C2O4)2]nH2O қосылыстары бөлініп алынды және олар оксалаттың артық мөлшерінде еритіні анықталды. Индий оксалаты су молекуласының әр түрлі санымен — 0-ден 8-ге дейін — кристалданады, суда аз ериді (51-4 моль/л), қымыздық қышқылында да аз ериді (1∙10'3 моль/л). 210°С-қа дейін қыздырса оксиоксалат Іn2О(С2О4)2 түзіледі, ал 520°С-та ол толық СО2 мен Іn2О3 ыдырайды.
Индий тартраты қасиеті бойынша галлий тартратына өте жақын /1074/, бірақ тұрақтылығы төмен.
Таллийдің комплексті қосылыстары да алуан түрлі және көп. Үш валентті таллий галогенидінің аммиакаттары белгілі - TІCІ33NH3. Ф.Я.Кульба мен В.Е.Миронов /1075/ ТІІ3 иодтың спиртті ерітіндісімен әрекеттестіріп таллоүшиодидін ТІІІ2 және полииодидін алған — TІl5, олар 70-80°С температурада T1I және І2 ыдырайтын қара жылтыр қабыршақтар. Сонымен қатар, Т1І3 диоксанмен қосылып алынған.
Таллий иодидін калий иодиді ерітіндісінде ерітсе бір қатар комплексті қосылыстар түзіледі - T112- , ТІІ32- ТІІ43-.
Ерігіштігі температурадан тәуелді: егер 20°С-та 1,5М калий иодидінде 1,49-10-5 моль/л ТІI ерісе, 70°С-та 11,39∙10-5 моль/л ериді. Суретте таллий иодидінің 20°С температурадағы калий иодидінің концентрациясынан тәуелділігі келтірілген.
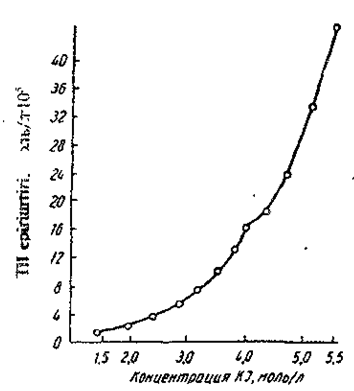
Сурет. Таллий иодиді ерігіштігінің калий иодиді концентрациясынан тәуелділігі
Өзі бір және үш валентті ионның ролін атқаратын комплексті қосылыстарды таллий оңай түзеді, мысалы Т1(Т1С14), ТІ(Тll8), Tl2[Ti(NО3)5]. Таллий сонымен қатар комплексті органикалық қосылыстар түзеді - ТІС13С2Н5ОН және Т1С13(С2Н5)2О. TiCNS-ті натрий, калий, литий, цезий роданидтерінде еріту арқылы алынған бір валентті таллийдің роданидті қосылыстары белгілі.
Үш валентті таллийдің фенантролинмен және дипиридилмен қосылыстары суда (310s моль/л) және спиртте (10-4 моль/л) ерімейді. Аналитикалық химияда кеңінен қолданылатын арилметан қатарының органикалық бояуыштарымен метил күлгін, малахит және бриллиант жасылы, аурамин, родамин таллий қосылыстары әр түрлі комплекс береді. Бұл реактивтердің толық сипаттамасы В.П.Гладышев жұмысында берілген. Таллийдің, индий мен галлийдің күрделі металлорганикалық қосылыстары белгілі.
Жоғарыда қарастырылғаи индий, галлий және таллийдің қос нитраттары және ашудастары да комплексті қосылыстарға жатады, бірақ тұрақтылығы өте төмен.
Әдебиеттер тізімі:
1. Ферсман А.Е. Редкие металлы. 1932, № 4-5.
2. Сажин Н.П., Меерсон Г.А. Редкие элементы в новой технике // Хим. наука и пром., 1956. Т.І, № 5.
3. Меерсон Г.А. и Зеликман А.Н. Металлургия редких металлов. Метиаллургиздат, 1954.
4. Зеликман А.Н., Самсонов Г.В., Крейн О.Е. Металлургия редких металлов. Металлургиздат, 1954.
5. Тронов В.Г. Кклад русских ученых в химию редких элементов. Изд. Знание, 1952.
6. Виноградов А.П. Геохимия редких и рассеянных химических элементов в почвах. Изд. АН СССР, 1950.
Әлеуметтік желілерде бөлісіңіз:
Пікірлер (0)
Пікір қалдырыңыз
Қарап көріңіз
Басқа да жазбалар
- Жастар және ақпараттық тәуелділік: цифрлық әдеттер
- «Мәдениет және тұрмыс» журналы: ұлттық рухани кеңістіктің айнасы
- Міндетін өтеп, өмірін жоғалтқандар
- Тұрмыстық зорлық-зомбылыққа бейім ер клиенттермен психологиялық жұмыс
- Тұрмыстық зорлық-зомбылыққа бейім ер клиенттермен психологиялық жұмыс
- Бүйрек,бүйрекүсті безінің анатомиялық құрылымы, морфологиясы, гормондық қызметі және клиникалық маңызын талдап, жүйелеу.
- Бүйрек,бүйрекүсті безінің анатомиялық құрылымы, морфологиясы, гормондық қызметі және клиникалық маңызын талдап, жүйелеу
- Көшелердің аттарын өзгерту туралы
- Отбасылық қатігездікке ұшыраған әйелдер мен балалар проблемасы аясындағы фильмдерге талдау.
- Отбасында ер адамға қатыгездік. Б.Лукалдың конструктивтік концепция теориясына сүйене отырып отбасында ер адамға (күйеуіне) қатыгездік себептерін талдау
- Отбасында ер адамға қатыгездік. Б.Лукалдың конструктивтік концепция теориясына сүйене отырып отбасында ер адамға (күйеуіне) қатыгездік себептерін талдау.
- Отбасындағы ер адамға қатысты қатыгездік: Б.Лукальдың конструктивті тұжырымдамасы арқылы талдау
- Шоқан Уәлихановтың 190 жылдығына орай:ағартушылық идеялары мен ғылыми мұрасы
- Агрессия теориясы. Инстинкт (теория З.Фрейда, К. Лоренца), ынталандыру (Берковиц теориясы); қозу теориясы (теория переноса возбуждения Зильманна), оқу (теория А.Бандуры)
- Агрессия теориялары


- Конфуций
- Конфуций
- Эдвард Дж. Стиглиц
- Нельсон Мандела
Барлық авторлар
Ілмек бойынша іздеу
Мақал-мәтелдер
Қазақша есімдердің тізімі