Литийдің физикалық және химиялық қасиеттері, оттекпен қосылыстары
Оңтүстік Қазақстан обылысы
Шардара ауданы
№ 16 колледж
Орындаған: Тұ-43 топ студенті Рысмұрат Болдықыз Мұхтарқызы
Жетекшісі: Айтенова Нұргул Ыдырысқызы
Литий - қалыпты жағдайда газ тәрізді емес элемент.
Металдық литийдің меншікті салмағы 0,534, сондықтан ол бензинде де тұтанады. Натрий жөне калий сияқты литий әлсіз сары түсі, металдық жылтыры бар, натрий калийге ұқсас өте жұмсақ.
Литийдің нормальды потенциалы белгілі потенциалдар ішіндсгі теріс мәнді. Ол - 3,02 в-ке тең. Мұндай үлкен теріс потенциал мәні литий ионының жоғары гидратациясымен байланысты. Сондықтан литийді сулы ерітіндіден электролиз арқылы бөлу мүмкін емес. Тұз балқымаларында литий потенциалы оң мәнді — 2,1в. Алғаш рет металдық литийді Деви литий оксидін вольт діңгегі арқылы ыдырату жолымен алды, ал кейінірек Бунзен мен Маттисен балқытылған хлорид электролизі арқылы алды (1855 ж.).
Литий - типтік металл, бірақ басқа сілтілік металдардан ерекшеленеді және магниймен "диагональдар" ережесі бойынша ұқсастығы бар. Li+ және Мg2+ иондық радиустары бірдей (0,78Аº). Литийдің Мg-мен ұқсастығы оның кейбір тұздарының фосфат және карбонаттарының өте аз ерігіштігінен байқалады, лнтий басқа сілтілік металдарға қарағанда және магаийге ұқсас ашудас түзе алмайды. Бұл қасиеттері литийлі қосылысты өндіруде қолданады.
Lі басқа сілтілік металдарға қарағанда жоғары балқу температурасын көрсетеді және ауамен салыстырғанда тұрақтырақ. Бірақ литий металл түрінде қолданылмайды, себебі ол ауадағы азотпен Lі3N түзеді. Басқа сілтілік металдарға сөйкес суды ыдыратады, бірақ натрий мен калийге қарағанда және рубидий мен цезийге қарағанда аздап энергиялы (балқымайды және жарқылы жоқ).
Литий фтор және хлормен қалыпты температурада қосылады, сутекпен қыздырғанда гидрид LіН түзеді. Литий қыздырғанда көміртек оксидімен де әрекеттеседі.
Литийдің осындай активтілігіне байланысты безин және парафин майымен бірге сақтау керек.
Сүйытылған қышқылдарда литий тез ериді, бірақ концентрлі Н2SО4 оны ақырын ерітеді, ал концентрлі азот қышқылы литийді күшті тотықтыратыны сонша, ол балқып сосын Жалындайды /1219/.
Оттекпен қосылыстары
Литий оттекте жанғанда ақ тотық Lі2О түзіледі. Сонымен Lі басқа сілтілік металдардан ерекшеленеді, олар пероксидті қосылыстар береді. Кейбір мөлшері Li2О2-нің литий оксидімен біріге түзіледі, бірақ литий пероксидінін беріктігі, басқа сілтілік металдардың пероксидтеріне қарағанда жоғары емес: 195°С-та ол толығымен литий оксидіне және оттекке ыдырайды. Литий оксидінің түзілу жылуы 142,3ккал/моль.
Литий оксиді оңай, бірақ басқа сілтілік металдар оксидіне қарағанда аздап энергиялы, сумен келесі реакция бойынша түзіледі:
Lі2О+Н2О → 2LiOН
Реакция көп мөлшерде жылу мөлшері бөлінуі мен жүреді: Lі оксидінің, гидроксидтерінің ерігіштігі судағы (моль/л) басқа сілтілік металл гидроксидтеріне қарағанда аздау (150C).
|
LiOH |
5,3 |
RbOH |
17,9 |
|
NaOH |
26,4 |
CsOH |
25,8 |
|
KOH |
19,1 |
|
|
Сулы ерітінділерден литий гидроксиді бір молекула суы бар кристаллогидрат түрінде кристалданады LiОН · Н2О.
Егер литий гидрооксидін сутек псроксидімен өңдесе, литийдщ пероксидті қосылыстарын алуға болады LiО2Н2О2ЗН2О, оны вакуумда кептірсе сусыз литий пероксиді түзіледі; кұрамы басқа пероксидті қосылыста белгілі - Li2О2-2Н2О.
Оттекті қышқылдың тұздары
Литийдің түрлі тұздары литий бар шикізтты және литийдің аналитикалық химиясында маңызды роль атқарады. Жоғарыдағы кейбір тұздардың ерігіштігі — карбонаттар, фосфаттар және басқалардың - басқа сілтілік металдардың сәйкес тұздарына қарағанда ерекшеленеді, сондықтан LiMg-ге жақын. Тұздардың ерігіштігіндегі мұндай айырмашылық литийді табиғатта бірге кездесетін сілтілік металдардан бөлуге мүмкіндік береді. 1 суретте литий сульфаты және карбонатының температураға тәуелді ерігіштігі берілген, салыстыруға калий сульфатының ерігіштігінің қисығы берілген. Калий карбонаты ерігіштігінің қисығы масштабтың шегіне шығады, оны төмендегі сандарды қарастырып онай көруге болады:
|
Температура, 0С |
0 |
10 |
20 |
25 |
30 |
100 |
|
Судың ерігіштігі г/100г |
||||||
|
Li2 CO3 |
1,53 |
1,42 |
1,33 |
1,27 |
1,18 |
0,66 |
|
K2 CО3 |
- |
109 |
110 |
- |
121 |
056 |
Na және К иондары қатысында және көміртегі тотығы қатысында литий карбонатының ерігіштігі қос және комплекеті қосылыстар түзілуі нәтижесінде өседі. Литий карбонаты сілтіде оңай ериді және литийдің басқа тұздарын алуда шикізат болып табылады. Мысалы:
Li2СО3+2НС1 -> 2LiС1+Н2О+СО2.
Литий карбонаты өндірісіндегі маңызды тұз болып табылады, себебі литийді кендерден өндеу процесі оны аз еритін карбонат түрінде тұнбаға түсірумен аяқталады.
1 суреттен корініп тұрғандай литий сульфатының ерігіштігі қалыпты температураларда калий сульфаты ерігіштігіне қарағанда жоғары және оған тек 100°С-да ғана жақындайды, сондай жағдайда калий сульфаты ерігіштігі жоғарылайды. Бұл қасиет литий кендерін өндеуде қолданылады. Литий басқа сілтілік металдарға қарағанда ашудас түзбейді, натрий, калий не аммониймен қос сульфат түзеді.
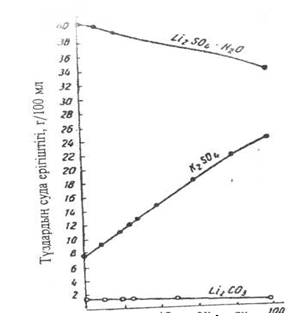
Температура, 0
1 сурет - Литий сульфаты мен карбанатының температураға байланысты ерігіштігі
Жай сульфат ерітінділерінен моногидрат түрінде LiSO4 H2O кристалданады. Басқа кристалдық түрлері литий сульфаты үшін белгісіз. Литйи басқа сілтілік металдрға ұқсас тұз түзеді: LiHSO4, ол қызыдырғанда пиросульфатқа ауысады LI2C2O; қалыпты сульфаттар натрий, калий және басқа сілтілік металдардың сутек ағынына тотықсыздану мүмкін немесе аммиакты сулфитке дейін, тотықсыздану температуралары сілтілік металдың сулбфаттры үшін бірдей (7000С – жуық сутек жіне 8000С – жуық аммиак).
Li3PO4 литий фосфаты 0,022г 100г суда ериді (00С – да), Na3PO4 ерігіштігі 10,5г 100г суда (150С), K3PO4 193,1г 100г суда (250С).
Кремний қышқылдық литий суду ерімейтін тұз, натрий жіне калий тұздары жақсы ериді (сұйық шыны). Кремний қышқылдық литийдің түзілуі тіпті, металдық литийдің кремний қышқылдық қосылыстармен әрекеттесуінде де оңай өтеді. Бұл жағдай қайта литийдің балқуын қиындатады.
Әдебиеттер тізімі:
1. Ферсман А.Е. Редкие металлы. 1932, № 4-5.
2. Сажин Н.П., Меерсон Г.А. Редкие элементы в новой технике // Хим. наука и пром., 1956. Т.І, № 5.
3. Меерсон Г.А. и Зеликман А.Н. Металлургия редких металлов. Метиаллургиздат, 1954.
4. Зеликман А.Н., Самсонов Г.В., Крейн О.Е. Металлургия редких металлов. Металлургиздат, 1954.
5. Тронов В.Г. Кклад русских ученых в химию редких элементов. Изд. Знание, 1952.
6. Виноградов А.П. Геохимия редких и рассеянных химических элементов в почвах. Изд. АН СССР, 1950.
Әлеуметтік желілерде бөлісіңіз:
Пікірлер (0)
Пікір қалдырыңыз
Қарап көріңіз
Басқа да жазбалар
- Жастар және ақпараттық тәуелділік: цифрлық әдеттер
- «Мәдениет және тұрмыс» журналы: ұлттық рухани кеңістіктің айнасы
- Міндетін өтеп, өмірін жоғалтқандар
- Тұрмыстық зорлық-зомбылыққа бейім ер клиенттермен психологиялық жұмыс
- Тұрмыстық зорлық-зомбылыққа бейім ер клиенттермен психологиялық жұмыс
- Бүйрек,бүйрекүсті безінің анатомиялық құрылымы, морфологиясы, гормондық қызметі және клиникалық маңызын талдап, жүйелеу.
- Бүйрек,бүйрекүсті безінің анатомиялық құрылымы, морфологиясы, гормондық қызметі және клиникалық маңызын талдап, жүйелеу
- Көшелердің аттарын өзгерту туралы
- Отбасылық қатігездікке ұшыраған әйелдер мен балалар проблемасы аясындағы фильмдерге талдау.
- Отбасында ер адамға қатыгездік. Б.Лукалдың конструктивтік концепция теориясына сүйене отырып отбасында ер адамға (күйеуіне) қатыгездік себептерін талдау
- Отбасында ер адамға қатыгездік. Б.Лукалдың конструктивтік концепция теориясына сүйене отырып отбасында ер адамға (күйеуіне) қатыгездік себептерін талдау.
- Отбасындағы ер адамға қатысты қатыгездік: Б.Лукальдың конструктивті тұжырымдамасы арқылы талдау
- Шоқан Уәлихановтың 190 жылдығына орай:ағартушылық идеялары мен ғылыми мұрасы
- Агрессия теориясы. Инстинкт (теория З.Фрейда, К. Лоренца), ынталандыру (Берковиц теориясы); қозу теориясы (теория переноса возбуждения Зильманна), оқу (теория А.Бандуры)
- Агрессия теориялары


- Конфуций
- Конфуций
- Эдвард Дж. Стиглиц
- Нельсон Мандела
Барлық авторлар
Ілмек бойынша іздеу
Мақал-мәтелдер
Қазақша есімдердің тізімі