Автопротолиз. Сутектік көрсеткіш
Оңтүстік Қазақстан обылысы
Шардара ауданы
№ 16 колледж студенті
Орындаған: Ф-40 топ студенті Әмір Нұржан Анарбекұлы
Автопротолиз реакциясы барысында біртүрлі еріткіш молекулаларының бірі протонын беріп, екіншісі оны қосып алып тепе-теңдік орнайтындығын аддыңғы тақырыптан хабардар болдық, яғни:
H2O+H2O ⇔H3O++OH-
NH3+NH3 ⇔ NH+4+NH-2
CH3OH+CH3OH ⇔CH3OH2+ CH3O-
Жалпы жағдай үшін:
HSolv+HSolv ⇔H2Solv++Solv-
Тепе-тендікті сандық тұғыда сипаттау үшін тепе-теңдік константа өрнегін жазалық:
K=[H3O+]*[OH-]/[H2O]*[H2O]
K=[H2Solv+]*[Solv-]/[HSolv]*[HSolv]
Диссоциациялануға еріткіш молекуласының өте аз бөлігі ұшырайтын болғандықтан оның концентрациясын тұрақты деп қабылдаймыз да, тепе-теңдік константасына көбейтіп жібереміз:
K*[H2O]2=Kw=[H3O+]*[OH-]
K*[HSolv]=KHSolv=[H2Solv+]*[Solv-]
Теңдеулердің біріншісі кәдімгі өзімізге таныс судың иондық көбейтіндісі. Екінші теңдеу де еріткіштің немесе лионий - лиат иондарының көбейтіндісі және KHSolv - шамасы автопротолиз константасы деп аталады.
Бөлме температурасы (~25°С) жағдайында судың иондық көбейтіндісінің мәні 1*10-14 -ке тең, яғни
Kw=[H3O+]*[OH-]=1*10-14
Теңдіктен [H3O+]=[OH-] жағдайында [H+] шамасын анықталық:
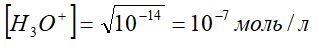
Жазылу қарапайым болу үшін және өзімізге бұрыннан көзтаныс H3O+ орнына H+-ті пайдалансақ [H+]=10-7моль/л
Қолдануға ыңғайлы болу үшін ондық логарифм жүйесін пайдаланып -lg[H+] ≈ pH, ал -lg[OH-] ≈ pOH деп белгілеп, бұларды сутектік және негіздік көрсеткіш деп атайды. Судағы ерітінділер үшін оның рН мәніне қарай ортаны бейтарап, қышқылды және негіздік деп үшке бөледі.
1. [Н+] = [ОН-] = 10-7 моль/л, рН = 7, орта бейтарап.
2. [Н+] > [ОН-]; [Н+] >10-7 моль/л, рН < 7 қышқылды орта.
3. [Н+] < [ОН-]; [Н+] <10-7 моль/л, рН > 7 сілтілі орта.
Егер, pH+pOH=14 екендігін ескерсек кез-келген судағы ерітінді үшін сутектік көрсеткіш мәні төмендегіше анықталады:
pH=14-pOH
Айтқандарымызды жалпы еріткіштер мен су үшін жазатын болсақ төмендегідей өрнек аламыз:
Еріткіш су Амфипротонды еріткіш
H2O ⇔ H++OH- HSolv ⇔ H++Solv-
немесе немесе
2H2O ⇔ H3O++OH- 2HSolv ⇔ H2Solv++Solv-
Kw=[Н+] *[OН-] KHSolv=[Н] *[Solv-]
немесе немесе
Kw=[Н3O+] *[OН-] KHSolv=[Н2Solv+] *[Solv-]
pKw=pH+pOH pKHSolv=pH+pSolv
[Н+]=[OН-] [Н]=[Solv-]
pH=1/2pKw <— Бейтарап орта—> pH=1/2pKHSolv
[Н+]>[OН-] [Н]>[Solv-]
pH<7 <— Қышқылдық орта —> pH<pSolv
[Н+]<[OН-] [Н]<[Solv-]
pH>7 <— Сілтілік орта —> pH>pSolv
Қышқылдық ортаны көрсететін шкала су үшін 0 мен 14 аралығында жатса, өзге еріткіш үшін "0" ден pKHSolv аралығьн алады. Амфипротонды кейбір еріткіштердің автопротолизі 1 - кестеде келтірілген
Амфипротонды еріткіштердің автопротолизі
|
Еріткіш HSolv |
Лионий H2Solv+ |
Лиат Solv- |
KHSolv |
pH шкаласы |
Бейтарап орта мәні pH=1/2 pKHSolv |
|
H2O |
H3O+ |
OH- |
10-14 |
0-14,0 |
7 |
|
H2SO4 |
H3SO+4 |
HSO-4 |
10-3,6 |
0-3,6 |
1,8 |
|
HCOOH |
HCOOH+2 |
HCOO- |
10-6,7 |
0-6,7 |
3,35 |
|
CH3COOH |
CH3COOH |
CH3COO- |
10-14,4 |
0-14,4 |
7,2 |
|
CH3OH |
CH3OH+2 |
CH3O- |
10-17,3 |
0-17,3 |
8,65 |
|
C2H5OH |
C2H5OH+2 |
C2H5O- |
10-19 |
0-19,0 |
9,5 |
|
NH3 |
NH+4 |
NH-2 |
10-22 |
0-22 |
11,0 |
|
CH3-CN |
CH3CNH+ |
CH3CN- |
10-19,5 |
0-19,5 |
9,75 |
Демек, кез-келген еріткіш үшін, орта қышқылдығы немесе сілтілігін лионий немесе лиат иондарының концентрациясымен (активтілігімен) сипаттауға болады. Қолдануда ыңғайлы болу үшін, кәдімгі өзімізге таныс pH және pOH сияқты pH және p[Solv-] мәндерін пайдаланады. Мұндағы pH және pOH - сутектік және негіздік көрсеткіш болып аталатындықтан жалпы жағдай үшін, p[Solv-]-те негіздік көрсеткіш болып аталады.
Есімізге түсірелік!
Су үшік, Kw=[H+]* [OH-]; pKw=pH+pOH;
Еріткіш үшін, KHSolv=[H]* [Solv-]; p KHSolv=pH+pSolv; .
Егер, pH=0 болса, онда pOH=pKw және p[Solv-]=p KHSolv Ал, pOH=0 болса, онда pH=pKw және pH=pKHSolv.
Демек, еріткіш қышқылдығын сипаттайтьн сутектік көрсеткіш "0" ден pKHSolv (су үшін 0 ден 14-ке дейін) дейінгі аралықта жатады.
Мұндағы KHSolv - кәдімгі судың ионды көбейтіндісі KH2O іспеттес еріткіштің иондық көбейтіндісі немесе автопротолиз константасы деп аталады.
Еріткіштерде pH мәні температураға да көп байланысты. Мысалы, температураға қарай су үшін pKw мәні төмендегіше өзгереді.
1°С 0 22 50 80 100
pKw 14,82 14,00 13,26 12,60 12,26
Егер бөлме температурасында бейтарап орта үшін pH-мәні 7,00 болса, 100°С үшін бұл мән 6,13 -ті құрайды.
Әлеуметтік желілерде бөлісіңіз:
Пікірлер (0)
Пікір қалдырыңыз
Қарап көріңіз
Басқа да жазбалар
- Жастар және ақпараттық тәуелділік: цифрлық әдеттер
- «Мәдениет және тұрмыс» журналы: ұлттық рухани кеңістіктің айнасы
- Міндетін өтеп, өмірін жоғалтқандар
- Тұрмыстық зорлық-зомбылыққа бейім ер клиенттермен психологиялық жұмыс
- Тұрмыстық зорлық-зомбылыққа бейім ер клиенттермен психологиялық жұмыс
- Бүйрек,бүйрекүсті безінің анатомиялық құрылымы, морфологиясы, гормондық қызметі және клиникалық маңызын талдап, жүйелеу.
- Бүйрек,бүйрекүсті безінің анатомиялық құрылымы, морфологиясы, гормондық қызметі және клиникалық маңызын талдап, жүйелеу
- Көшелердің аттарын өзгерту туралы
- Отбасылық қатігездікке ұшыраған әйелдер мен балалар проблемасы аясындағы фильмдерге талдау.
- Отбасында ер адамға қатыгездік. Б.Лукалдың конструктивтік концепция теориясына сүйене отырып отбасында ер адамға (күйеуіне) қатыгездік себептерін талдау
- Отбасында ер адамға қатыгездік. Б.Лукалдың конструктивтік концепция теориясына сүйене отырып отбасында ер адамға (күйеуіне) қатыгездік себептерін талдау.
- Отбасындағы ер адамға қатысты қатыгездік: Б.Лукальдың конструктивті тұжырымдамасы арқылы талдау
- Шоқан Уәлихановтың 190 жылдығына орай:ағартушылық идеялары мен ғылыми мұрасы
- Агрессия теориясы. Инстинкт (теория З.Фрейда, К. Лоренца), ынталандыру (Берковиц теориясы); қозу теориясы (теория переноса возбуждения Зильманна), оқу (теория А.Бандуры)
- Агрессия теориялары


- Конфуций
- Конфуций
- Эдвард Дж. Стиглиц
- Нельсон Мандела
Барлық авторлар
Ілмек бойынша іздеу
Мақал-мәтелдер
Қазақша есімдердің тізімі