Бериллийдің бейорганикалық қосылыстары
Оңтүстік Қазақстан обылысы
Шардара ауданы
№ 16 колледж
Орындаған: Тұ-43 топ студенті Мамбет Ұлбосын Талғатқызы
Жетекшісі: Айтенова Нұргул Ыдырысқызы
Галогендермен қосылыстары
Бериллий тікелей галогендермен қосылады: фтормен бөлме температурасында, хлормен, бром және иодпен қыздырғанда. Бериллий фториды және хлориды оның маңызды қосылыстары, бериллий кендерін өңдегенде қолданылады.
ВеҒ2 - бериллий фториды түссіз, шыны тәріздес зат, 577 + 100С температурада балқиды. 800°С-да бериллий фториды қозғалмалы сұйықтыққа айналады, ол осы температурада булана бастайды.
ВеҒ2-нің қаныққан бу қысымы жұмыс авторларының мәліметі бойынша 846К-да 1,76210-3мм сынап бағанасымен, 949,5К-да 6,18410-2мм сынап бағанасы бойынша жетеді. Магний фторидінен айырмашылығы бериллий фториді суда жақсы ериді. Бериллийдің жай және қос фторидтерінің ерітінділері толығымен зерттелген.
И.В.Тананаев және Э.Н.Дейчман ВеҒ2 ерітіндісін физика-химиялық анализ әдісімен зерттей отырып мынадай қорытынды жасады. ВеҒ2 — НҒ - Н2О жүйесінде бериллий комплексті ион түзеді, мұнда ең тұрақтырағы ВеҒ+ ионы, оның тұрақсыздық константасы 5∙10-5. Осыған ұқсас қорытындылар бериллийдің фторидті комплекстерін колориметрлік анализ әдісімен зерттеу кезінде де алынған.
LiF-BeF2 жүйесінде литий фториді мен бериллий фторидінің түрлі қатынастарымен ерекшеленетін және сонымен бірге балқу температураларында едәуір айырмашылық болатын қос фторидтер, мысалы: 2LiFBeF2 (немесе Li2BeF4) және LiF2BeF4 (немесе LiBe2F5) түзілетіні анықталған. BeF2 алюминийдің сәйкес қосылыстарынан айырмашылығы калий және натрий фторидтерімен суда еритін комплексті қосылыстар (Na, K)2BeF4 және (Na, K)BeF3 береді. Осыған байланысты бериллий фторидінің комплекстері бериллийді алюминийден бөлуде практикалық маңызы өте зор.
Комплексті фторид (NH4)2BeF4 қыздырғанда ВеҒ2 бөле отырып ыдырайды. Осы процесті төменгі температурада термогравиметрлік әдіспен зерттегенде, ыдырау процесі үш сатымен өтетіні анықталады:
(NH4)2BeF4 → NH4BeF3 → NH4Be2F5 →BeF2
ВеСl2 түссіз кристалдар, ылғалтартқыш, суда жақсы ериді, балқу температурасы 405, қайнау температурасы 487°С. Төменде ВеС12-нің әр түрлі температурадағы серпімділігі шамалары көрсетілген. Суретте осы тәуелділік графикалық түрде көрсетілген.
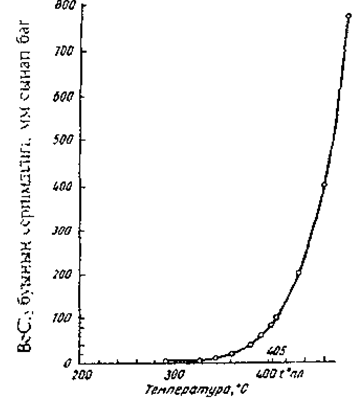
ВеСl2 буы серпімділігінің температурадан тәуелділігі
|
Температура, 0С |
291 |
328 |
365 |
395 |
411 |
435 |
461 |
|
Будың серпімділігі, мм.рт,ст |
1 |
5 |
20 |
60 |
100 |
200 |
400 |
Суреттен ВеСl2 — буының серпімділігі оның балқу температурасына дейін байқалады және жоғары температурада тез өсе бастайды. ВеС12-ні оңай айдау мүмкіншілігі үшін практикада кеңінен қолданады.
Сусыз ВеСl2-ні газ тәрізді хлормен бериллий оксидін көміртек қатысында 700°С-да әрекеттестіру арқылы алады:
ВеО + С + Сl → ВеС12 + СО
Бірақ басқа да хлорлаушы сегменттер — фосген, төртхлорлы көміртек қолдануға да болады.
ВеСl2 суда жақсы ериді және сулы ерітіндіден төрт молекуласымен кристаллогидрат ВеС12-4Н2О түрінде кристалданады, қыздырғанда бұл тұз бериллий хлороксидіне (негізгі тұз) айналады, ол суда өте қиын ериді.
Құрамында калий және литий хлориді және 10% бериллий хлориді бар балқыманы электролиздегенде (электродтар - бериллий мен молибден) молибденді электродтың потенциалы уақытқа байланысты өзгеруі байқалды.
Бұл жағдай Ве2+/Ве тотығу-тотықсыздану жүйесіндегі Ве+ иондарының пайда болуына байланысты. Ве+Ве2+ ↔ Ве+ реакциясы қайтымды және балқыманың температурасын төмендеткенде немесе Ве2+ иондарына байланыстыратын фтор иондарын қосқанда сол жаққа ығысады. Осындай жағдайда бериллийдің бір валентті болатыны дәлелденді деп есептеуге болады, бірақ тек жоғары температурада.
Көміртекпен қосылыстары
Бериллийдің екі карбиді белгілі — Ве2С және ВеС2. Біріншісі электрлік пеште бериллий оксидін қыздырғанда алынады, сумен метан бөле отырып ыдырайтын қызыл түсті зат. ВеС2-ні 450°С-та металдық бериллийді ацетиленмен әрекеттестіріп алады.
Күкіртпен қосылыстары
Бериллий тұздарының ерітіндісіне күкіртсутек жібергенде тұнба бөлінбейді, себебі бериллий сульфиді сумен бірге жүре алмайды. Ол сумен күкіртсутек бөле отырып ыдырайды:
BeS + 2H2O → Be(OH)2 + H2S
Берилий сульфидін құрғақ күйде бериллий ұнтағын күкірт буымен әрекеттестіргенде алынады. ЬІлғалды ауада сульфид ыдырайды, қыздырғанда SO2 бөле отырып тотығады.
Азотпен, фосформен және бормен қосылыстары
Металдық бериллий 700-1400°С-да азотпен 2200° балқитын және өте қатты Be3N2 нитрид түзеді. Нитрид басқа да түрлі әдістермен де, мысалы, металдық ұнтақ бериллийді 1000°С-да аммиакпен әрекеттестіргенде немесе 1250°С-та бериллий карбидін азотпен әрекеттестіргенде алу мүмкін. Бериллий нитриды минералды қышқылдармен аммиак бөле отырып ыдырайды.
Фосформен бериллий бір қосылыс фоссфид Ве3Р2 түзеді, оны металдық бериллий ұнтағын фосфор буымен әрекеттестіріп алады.
Бормен бериллий бірнеше қосылыстар түзеді — Ве5В, Bе2B, BеB2, ВеВ6. Боридтер 1160-тан 2000°С-ға дейінгі температура аралығында балқиды және өте жоғары электркедергісіне ие.
Осы барлық қиын балқитын бериллий қосылыстары қазіргі кезде жан-жақты зерттелу үстінде.
Әдебиеттер тізімі:
1. Ферсман А.Е. Редкие металлы. 1932, № 4-5.
2. Сажин Н.П., Меерсон Г.А. Редкие элементы в новой технике // Хим. наука и пром., 1956. Т.І, № 5.
3. Меерсон Г.А. и Зеликман А.Н. Металлургия редких металлов. Метиаллургиздат, 1954.
4. Зеликман А.Н., Самсонов Г.В., Крейн О.Е. Металлургия редких металлов. Металлургиздат, 1954.
5. Тронов В.Г. Кклад русских ученых в химию редких элементов. Изд. Знание, 1952.
6. Виноградов А.П. Геохимия редких и рассеянных химических элементов в почвах. Изд. АН СССР, 1950.
Әлеуметтік желілерде бөлісіңіз:
Пікірлер (0)
Пікір қалдырыңыз
Қарап көріңіз
Басқа да жазбалар
- Жастар және ақпараттық тәуелділік: цифрлық әдеттер
- «Мәдениет және тұрмыс» журналы: ұлттық рухани кеңістіктің айнасы
- Міндетін өтеп, өмірін жоғалтқандар
- Тұрмыстық зорлық-зомбылыққа бейім ер клиенттермен психологиялық жұмыс
- Тұрмыстық зорлық-зомбылыққа бейім ер клиенттермен психологиялық жұмыс
- Бүйрек,бүйрекүсті безінің анатомиялық құрылымы, морфологиясы, гормондық қызметі және клиникалық маңызын талдап, жүйелеу.
- Бүйрек,бүйрекүсті безінің анатомиялық құрылымы, морфологиясы, гормондық қызметі және клиникалық маңызын талдап, жүйелеу
- Көшелердің аттарын өзгерту туралы
- Отбасылық қатігездікке ұшыраған әйелдер мен балалар проблемасы аясындағы фильмдерге талдау.
- Отбасында ер адамға қатыгездік. Б.Лукалдың конструктивтік концепция теориясына сүйене отырып отбасында ер адамға (күйеуіне) қатыгездік себептерін талдау
- Отбасында ер адамға қатыгездік. Б.Лукалдың конструктивтік концепция теориясына сүйене отырып отбасында ер адамға (күйеуіне) қатыгездік себептерін талдау.
- Отбасындағы ер адамға қатысты қатыгездік: Б.Лукальдың конструктивті тұжырымдамасы арқылы талдау
- Шоқан Уәлихановтың 190 жылдығына орай:ағартушылық идеялары мен ғылыми мұрасы
- Агрессия теориясы. Инстинкт (теория З.Фрейда, К. Лоренца), ынталандыру (Берковиц теориясы); қозу теориясы (теория переноса возбуждения Зильманна), оқу (теория А.Бандуры)
- Агрессия теориялары


- Конфуций
- Конфуций
- Эдвард Дж. Стиглиц
- Нельсон Мандела
Барлық авторлар
Ілмек бойынша іздеу
Мақал-мәтелдер
Қазақша есімдердің тізімі